
【题目】在某温度下,向20 mL 0.1 mol/L 某一元酸HA溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中一定正确的是

A. a点表示溶液中c(A-)为0.1 mol/L
B. a、b、c、d点表示的溶液中一定有:c(H+)·c(OH-)=1×10-14
C. c点表示HA和NaOH恰好反应完全
D. b、d点表示的溶液中,其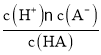 值一定不变
值一定不变
科目:高中化学 来源: 题型:
【题目】KIO3 是一种重要的无机化合物,常作为食盐中的补碘剂,工业上常用“KClO3 氧化法”制备 KIO3,其中酸化反应的产物有 KH(IO3)2、Cl2 和 KCl,流程如下:
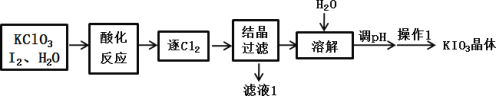
下列说法错误的是
A.酸化反应中还原产物为 KH(IO3)2
B.结晶过滤得到滤液 1 为 KCl 溶液
C.调节 pH 可加入 KOH,发生反应 KH(IO3)2+ KOH=2KIO3+ H2O
D.操作 1 可采用蒸发浓缩、冷却结晶的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中![]() 不变
不变
B. 醋酸的电离程度增大,溶液中导电粒子的数目减少
C. 若稀释到pH=4,所需水的体积等于90mL
D. 再加入10mLpH=11的NaOH溶液,混合后溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体均处于25℃,有关叙述正确的是
A. 某物质的溶液pH<7,则该物质属于酸或强酸弱碱盐
B. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C. pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
D. AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五种溶液:盐酸、NH3·H2O、NH4HSO4、NaOH、CH3COOH。回答下列问题:
(1)将1LpH=2的HCl溶液分别与0.01mol·L-1的NH3· H2O溶液x L、0.01 mol·L-1的NaOH溶液yL充分反应至中性,x、y大小关系为:y___x(填“>”“<”或“=”)。
(2)H+浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是____(填写序号)。
①反应所需要的时间CH3COOH >HCl
②开始反应时的速率HCl>CH3COOH
③参加反应的锌粉物质的量HCl=CH3COOH
④反应过程的平均速率CH3COOH>HCl
⑤HCl溶液里有锌粉剩余
⑥CH3COOH溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,升高温度(溶质不会分解)溶液pH随温度变化如图中的____曲线(填写序号)。
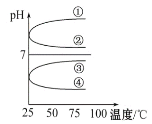
(4)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1NaOH溶液至中性,得到的溶液中:c(Na+)+c(NH4+)___2c(SO42- )(填“>”“=”或“<”);用NH4HSO4与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH___7(填“>”“=”或“<”)
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是____(用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___(填“正向”“不”或“逆向”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A。 | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液 | 紫色石蕊溶液滴入Na2O2中 | CCl4溶液滴入碘水 | Na在空气中放置 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变蓝,随后迅速褪色 | CCl4层由无色变为浅紫色 | 钠表面由银白色变暗 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为 +7价 | 基态原子中,电子占据的最高能层符号为L,最高 能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1) W的基态原子电子排布式为____, X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5 (气态或液态时)中,中心原子的轨道类型不是sp3杂化的是________(填化学式,下同),分子构型是正四面体的是______, 属于极性分子的是____。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为____,Y与氢元素能形成YnH2n+2 (n为正整数)的一系列物质,这一系列物质沸点的变化规律以及影响的因素是______________。
(4)Z可形成多种含氧酸,如H3ZO4、HZO3、H3ZO3等,其中酸性最强的是______(填化学式)。
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为r cm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为_____gcm-3。
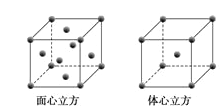
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com