
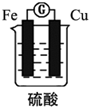
| A. | 该电池工作时电能转变为化学能 | B. | 铁片的质量变轻 | ||
| C. | 铜片上发生的反应2H++2e-=H2↑ | D. | SO42-向铁片移动 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
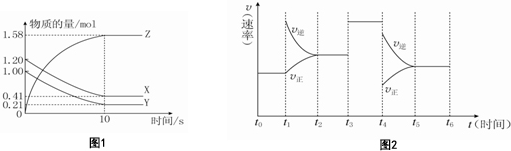
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
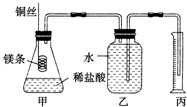 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径依次增大 | B. | 单质的熔沸点逐渐升高 | ||
| C. | 卤离子的还原性逐渐减弱 | D. | 氢化物的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
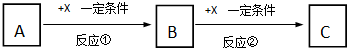
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com