
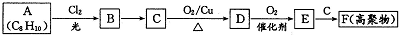
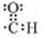 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
. .
. (2种即可).
(2种即可).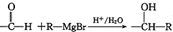 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则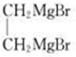 ,
,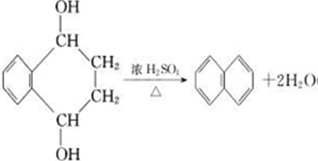 .
. 分析 A为烃,和氯气发生取代反应生成B,B反应生成C,C是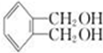 ,B是氯代烃,则B结构简式为
,B是氯代烃,则B结构简式为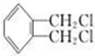 ,A为
,A为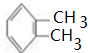 ,C在Cu作催化剂、加热条件下发生氧化反应生成D,D为
,C在Cu作催化剂、加热条件下发生氧化反应生成D,D为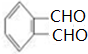 ,D发生氧化反应生成E,E为
,D发生氧化反应生成E,E为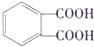 ,E和C发生缩聚反应生成高分子化合物F,F结构简式为
,E和C发生缩聚反应生成高分子化合物F,F结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:A为烃,和氯气发生取代反应生成B,B反应生成C,C是 ,B是氯代烃,则B结构简式为
,B是氯代烃,则B结构简式为 ,A为
,A为 ,C在Cu作催化剂、加热条件下发生氧化反应生成D,D为
,C在Cu作催化剂、加热条件下发生氧化反应生成D,D为 ,D发生氧化反应生成E,E为
,D发生氧化反应生成E,E为 ,E和C发生缩聚反应生成高分子化合物F,F结构简式为
,E和C发生缩聚反应生成高分子化合物F,F结构简式为 ,
,
(1)A为 ,A的名称为邻二甲苯,故答案为:邻二甲苯;
,A的名称为邻二甲苯,故答案为:邻二甲苯;
(2)D为 ,D中官能团是醛基,D中官能团电子式为
,D中官能团是醛基,D中官能团电子式为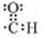 ;E和C发生缩聚反应生成F,所以反应类型是缩聚反应,
;E和C发生缩聚反应生成F,所以反应类型是缩聚反应,
故答案为: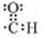 ;缩聚反应;
;缩聚反应;
(3)F结构简式为 ,故答案为:
,故答案为: ;
;
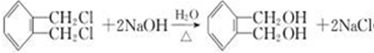
(4)C是 ,B结构简式为
,B结构简式为 ,B和NaOH的水溶液加热生成C,B-C的化学方程式
,B和NaOH的水溶液加热生成C,B-C的化学方程式 ,
,
故答案为: ;
;
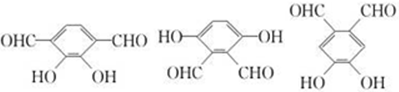
(5)E为 ,E的同分异构符合下列条件:
,E的同分异构符合下列条件:
①能发生银镜反应说明含有醛基,②遇三氯化铁溶液显紫色说明含有酚羟基,③核磁共振氢谱显示有3种峰,说明含有三种氢原子,符合条件的有 ,
,
故答案为: ;
;
(6)D为 ,D和G反应生成H,H发生消去反应生成J,根据D、J结构简式结合题给信息知,G为
,D和G反应生成H,H发生消去反应生成J,根据D、J结构简式结合题给信息知,G为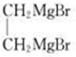 ,H为
,H为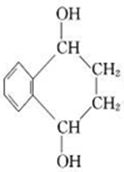 ,
,
①根据以上分析知,G的结构简式为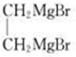 ,故答案为:
,故答案为: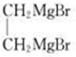 ;
;
②H发生消去反应生成J,H→J的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物推断,侧重考查学生分析推断能力,以C为突破口结合反应条件、题给信息进行推断,知道常见有机物官能团及其性质,难点是同分异构体种类判断,题目难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示某吸热反应分别在有、无催化剂的情兄下反应过程中的能量变化 | |
| B. | 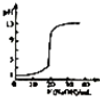 表示常温下,0.1 OOOmoi/LNaOH 溶液液滴定 20.00mL、0.0100/LHCl 溶液 所得到的滴定曲线 | |
| C. | 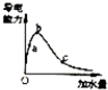 表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c>a>b | |
| D. | 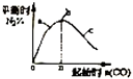 表示反应4CO+2NO2(g)?N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体识分数变化情况,由图可知NO2的转化率 c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 改变的条件 | 压强 | 温度 | 平衡体系增加H2 | 催化剂 |
| 变化的示意图 |  | 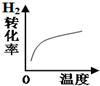 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A. | Z的氧化物对应的水化物一定是一种强酸 | |
| B. | 原子半径大小顺序是X>Y>Z | |
| C. | Y的单质比Z的单质更易与氢气反应 | |
| D. | Z的单质与Fe反应形成的化合物中,铁元素显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气 SO2、NO、NO2、CO | |
| B. | 碱性溶液 Na+、K+、NO3-、CO32- | |
| C. | 酸性溶液 Na+、ClO-、SO42-、SiO32- | |
| D. | KNO3溶液 Fe2+、H+、Cl-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com