
| A、一定温度下的可逆反应,只有达到平衡时才具有平衡常数 |
| B、改变外界条件使化学平衡状态改变时,平衡常数也一定改变 |
| C、对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| D、对于反应2NO2(g)?N2O4(g)正反应的平衡常数为K1,逆反应的平衡常数为K2,K1=K2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、反应的热化学方程式:2H2(g)+O2(g)=2H2O(g)△H=+483.6 kJ?mol-1 |
| B、氢气的燃烧热为241.8 kJ?mol-1 |
| C、1 mol H2O(l)的能量大于1 mol H2O(g)的能量 |
| D、2 mol H2和1 mol O2的能量总和大于2 mol H2O(g)的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、可用右图所示的方法将烧杯中的溶液转移到容量瓶中 |
| B、容量瓶可用于配制溶液,但不能作为反应容器使用 |
| C、稀释浓硫酸时,先向烧杯中注入浓硫酸,再加水稀释 |
| D、用托盘天平称量NaOH固体时,需将NaOH固体放在托盘上的纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
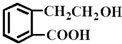 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质: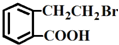 ②
②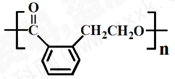 ③
③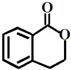 ④
④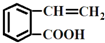
| A、酯化、取代、缩聚、取代 |
| B、取代、取代、加聚、消去 |
| C、取代、缩聚、酯化、消去 |
| D、取代、加成、酯化、消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与氧气反应 |
| B、铁在氯气中燃烧 |
| C、氯化铝溶液与氢氧化钠溶液 |
| D、二氧化碳与氢氧化钙溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有在标准状况下,48 g O3气体才含有6.02×1023个O3分子 |
| B、常温常压下,4.6 gNO2气体约含有1.81×1023个原子 |
| C、0.5 mol?L-1CuCl2溶液中含有Cu2+数小于3.01×1023个 |
| D、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
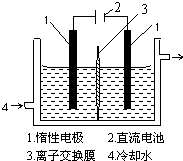 在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.
在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.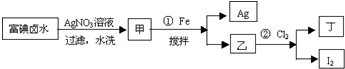
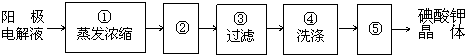
查看答案和解析>>
科目:高中化学 来源: 题型:
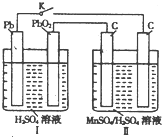 高锰酸钾和二氧化锰是中学化学常用的化学试剂.根据下面相关的信息回答下列问题:
高锰酸钾和二氧化锰是中学化学常用的化学试剂.根据下面相关的信息回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com