
| A. | 键能:H-F>H-Cl>H-Br>H-I | |
| B. | 还原性:Cl-<Br-<Fe2+<I- | |
| C. | 反应热:C(s)+O2(g)=CO2(g)△H1CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2△H1>△H2 | |
| D. | 酸性:向次氯酸钠溶液中通入少量的二氧化碳,发生ClO-+CO2+H2O=HCO${\;}_{3}^{-}$+HClO则说明酸性:H2CO3>HClO>HCO${\;}_{3}^{-}$ |
分析 A.键长越短,共价键越强,键能越大;
B.氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,据此解答即可;
C.C充分燃烧生成二氧化碳放出的热大于不充分燃烧生成CO放出的热,据此判断即可;
D.强酸能制取弱酸,据此解答即可.
解答 解:A.原子半径F<Cl<Br<I,故键长H-F<H-Cl<H-Br<H-I,键长越短,共价键越强,键能越大,故键能:H-F>H-Cl>H-Br>H-I,故A正确;
B.已知有反应:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2,故还原性:Cl-<Br-<Fe2+<I-,故B正确;
C.C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol;CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283.0kJ/mol,△H1<△H2,故C错误;
D.向次氯酸钠溶液中通入少量的二氧化碳,发生ClO-+CO2+H2O=HCO3-+HClO则说明酸性:H2CO3>HClO>HCO3-,故D正确,
故选C.
点评 本题主要考查的是键长键能大小比较、酸性强弱比较和反应热大小比较,综合性较强,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ①②⑤⑥⑦ | C. | ①③④⑥ | D. | ②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NH4HCO3溶液中:c(NH4+)+c(H+)=c(OH-)+c(HCO3-) | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 欲使Na2S溶液中c(Na+)于c(S2-)的比值恰好为2:1,可加入适量的KHS溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、2mol H2 | 1mol CH3OH | 2mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 平衡时压强(Pa) | P1 | P2 | P3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | c1=c3 | B. | a+c/2<90.7 | C. | 2P2>P3 | D. | α1+α3=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
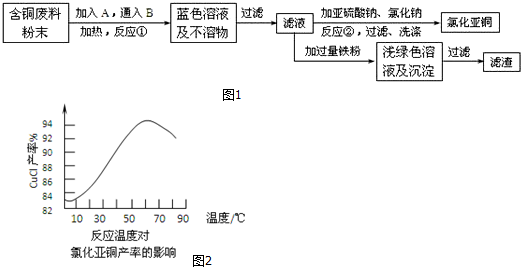
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
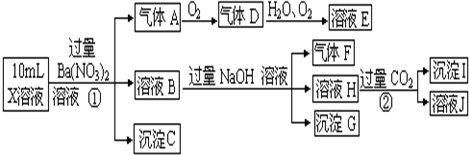
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
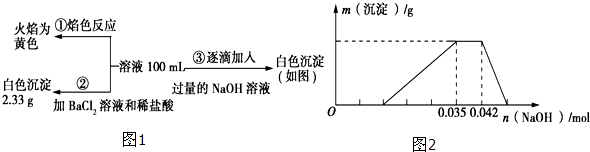
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com