
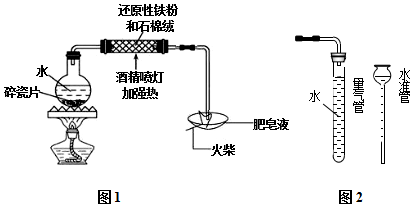
分析 (1)加热液体时,应防止液体暴沸;如忘记加入碎瓷片,应撤掉酒精灯,待完全冷却后再加入碎瓷片;
(2)加热体积,铁和水蒸气反应生成四氧化三铁和氢气,加入石棉绒,可增大反应物的接触面积;
(3)反应生成氢气,可用点燃肥皂泡比较安全,且易操作;
(4)取适量溶液滴加几滴KSCN溶液.若溶液变红色,说明含有铁离子,则生成四氧化三铁,如液未变红色,则生成亚铁离子;亚铁离子具有还原性,可与铁氰化钾反应生成蓝色沉淀;
(5)量取气体体积时,注意温度、压强的影响;
②反应的方程式为3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,结合方程式计算.
解答 解:(1)加热液体时,加入碎瓷片,可防止液体暴沸;如忘记加入碎瓷片,应撤掉酒精灯,待完全冷却后再加入碎瓷片,操作顺序为④②③①,
故答案为:防止暴沸;④②③①;
(2)铁与水蒸气发生氧化还原反应,生成Fe3O4和H2,方程式为3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,加入石棉绒,可增大铁粉与水蒸气的接触面积,使其反应更充分,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2; 增大铁粉与水蒸气的接触面积,使其反应更充分;
(3)反应生成氢气,通入肥皂水易生成肥皂泡,用点燃肥皂泡检验生成气体的方法比较安全,且易操作,故答案为:操作简便或更加安全;
(4)取适量溶液滴加几滴KSCN溶液.若溶液变红色,说明含有铁离子,则生成四氧化三铁,如液未变红色,则生成亚铁离子,则应生成四氧化三铁,且有铁剩余,加入盐酸生成亚铁离子;亚铁离子具有还原性,可与铁氰化钾反应生成蓝色沉淀,
故答案为:a; b;滴加酸性KMnO4溶液,KMnO4溶液褪色(或滴加K3[Fe(CN)6]溶液,生成蓝色沉淀);
(5)①量取气体体积时,注意温度、压强的影响,可冷却至室温,并调节量气管液面与水准管中液面相平,
故答案为:冷却至室温;调节量气管液面与水准管中液面相平;
②测得生成氢气体积为73.50mL(实验室条件下气体摩尔体积为24.5L•mol-1),则n(H2)=$\frac{0.0735L}{24.5L/mol}$=0.003mol,由反应的方程式3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2可知消耗0.00225molFe,则m(Fe)=0.00225mol×56g/mol=0.126g,
则铁粉转化率为$\frac{0.126}{0.1527}×100%$=82.5%,
故答案为:82.5%.
点评 本题综合考查物质的性质探究以及含量的测定,为高考常见题型和高频考点,侧重考查学生的分析能力、实验能力和计算能力,注意把握实验的原理、操作方法以及注意事项,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
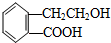 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.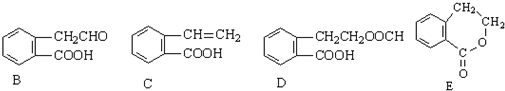
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 盛放氢氧化钠溶液的试剂瓶用橡胶塞 | 氢氧化钠可以与玻璃中的二氧化硅反应生成粘性的硅酸钠 | Ⅰ对,Ⅱ错,无 |
| B | 氯水可以使有色布条褪色 | 氯气具有漂白性 | Ⅰ错,Ⅱ对,有 |
| C | 二氧化硅可以与水反应生成硅酸 | 二氧化硅是酸性氧化物具有酸性氧化物的通性 | Ⅰ对,Ⅱ对,无 |
| D | 为增强漂白能力使用漂白粉时向漂白粉溶液中加入少量白醋 | 醋酸的酸性比次氯酸强 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,56g由N2和CO组成的混合气体含有的原子数目为4 NA | |
| B. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数为0.3NA | |
| C. | 1 L 1.0mol•L-1的NaAlO2水溶液中含有的总原子数为2NA | |
| D. | 1 mol羟基中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
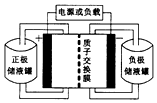 一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )
一种钒-多卤化物电池结构示意图如图所示,电池和储液罐均存储有反应物和酸性电解质溶液.电池中发生的反应为2VCl2+BrCl${\;}_{2}^{-}$$?_{放电}^{充电}$2VCl3+Br-下列说法正确的是( )| A. | VCl2存储在正极储液罐内 | |
| B. | 放电时H+从负极区移至正极区 | |
| C. | 充电时电池的负极与电源的正极相连 | |
| D. | 充电时阳极反应为Br-+2Cl--2e-═BrCl2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 预测的实验现象 | 实验结论或解释 | |
| A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+═H2O+CO2↑ |
| B | 将浓硫酸滴加到盛有铜片的试管中,并将 蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
| C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
| D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
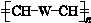 (W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图:
(W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图: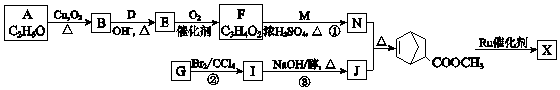
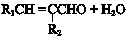
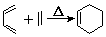
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$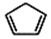 +2 NaBr+2 H2O.
+2 NaBr+2 H2O.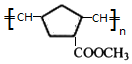 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Mg | C. | 稳定性:HF>CH4 | D. | 酸性:HF<HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com