
【题目】若已发现了116号元素则下列推断正确的是:①其钠盐的化学式为Na2R ②其最高价氧化物对应的水化物的酸性比硫酸强③R是金属元素④R是非金属元素⑤最外电子层有6个电子
A. ①②③ B. ①③⑤ C. ②④⑤ D. ③⑤
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种元素在周期表前四周期的位置如下图所示,下列说法正确的是

A. 元素b位于VIA族,有+6、-2两种常见化合价
B. 元素c的气态氢化物的稳定性比元素b的强
C. 元素b、c、d的原子半径大小顺序:r(d)>r(c)>r(b)
D. 元素e的单质可能是一种半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2与H2的混合气体5 g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4 g,则原混合气体中CO2的物质的量分数为 ( )
A.25% B.75% C.88% D.32%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类与我们的日常生活息息相关。关于糖类物质的说法正确的是
A. 糖类均有甜味 B. 淀粉和纤维素均不是糖类
C. 糖类均不可水解 D. 糖类都含有C、H和O元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。

当V1=160mL时,则金属粉末中n(Mg)=________ mol,V2=_____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) _____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼一般有下列四种方法:①焦炭法 ②水煤气(或H2、CO)法 ③活泼金属置换法④电解法。这四种方法在工业上均有应用。古代有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析,不正确的是
A.(Ⅰ),① B.(Ⅱ),② C.(Ⅲ),③ D.(Ⅳ),④
查看答案和解析>>
科目:高中化学 来源: 题型:
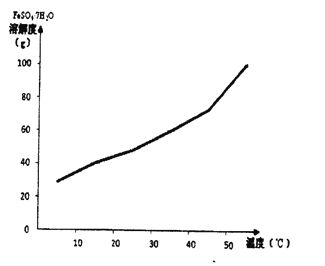
【题目】(1)绿矾晶体(FeSO4﹒7H2〇)由于保存不妥或长久放置,容易部分或全部被氧化,现有一瓶绿矾样品,想了解其是否被氧化和被氧化的程度,试选择合适的试剂,根据相关的实验现象进行推测(可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液等)。
①证明其完全没有被氧化的试剂是 现象是__________________;
②证明其已完全被氧化的试剂是 现象是____________________。
(2)己知FeSO4.7H2O的溶解度曲线如下图所示,则从硫酸亚铁饱和溶液中提取绿矾晶体采用的操作是__________________。
(3)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水
处理等领域具有重要的应用。SPFS可表示成SPFS可表示成Fex(OH)y(SO4)znH2O.工业上常用的一种制备流程为:
![]()
取5.349g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀8.155g,向上述滤液中加入NH3H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.000g.确定该固体聚合硫酸铁样品的化学式。(写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(1)CO2可用于生产甲醇,已知:2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。一定条件下,按不同的投料比X(X=n(H2)/n(CO2))向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。一定条件下,按不同的投料比X(X=n(H2)/n(CO2))向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1_______X2(填“>”或“<”,后同),Q_______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
③TK时,在该容积可变的恒压密闭容器中发生上述反应,测得有关数据如下表所示:
物质的量(mol) 时间(min) | 0 | 5 | 10 | 15 | 20 |
H2(g) | 6.00 | 5.40 | 5.10 | 5.80 | 5.80 |
CO2(g) | 2.00 | 1.80 | 1.70 | 1.60 | 1.60 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.20 | 0.20 |
已知在10min时只改变了一个反应条件,用改变的条件可能是______。
④下列情况下能表明该反应达到平衡状态的是_____。
a.气体密度不变 b.混合气休的平均摩尔质量不变 c.消耗速率:2v(H2O)=v(CO2)
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
① 若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=______ [常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是
A.Cu能与浓硝酸反应,而不与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Cu与浓硫酸反应,而不与稀硫酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com