
现有以下物质:①NaCl晶体, ②液态SO3, ③液态醋酸, ④汞,⑤BaSO4固体,⑥蔗糖(C12H22O11),⑦酒精(C2H5OH),⑧熔融KNO3
请回答下列问题(填序号):
(1)以上物质中能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3))以上物质中属于非电解质的是 ;
(4)以上物质中属于弱电解质的是 。
(1)④⑧ (2)①③⑤⑧ (3)②⑥⑦ (4)③
解析试题分析:(1)④汞中有自由电子,所以能导电;⑧熔化的KNO3中有自由移动的离子,所以能导电;①NaCl
晶体、②液态SO3、③液态醋酸、⑤BaSO4固体、⑥纯蔗糖(C12H22O11)、⑦酒精(C2H5OH)没有自
由移动的离子或自由电子,所以不能导电,故答案为:④⑧;(2)在水溶液里或熔融状态下能导电的
化合物是电解质,所以①NaCl晶体、③液态醋酸、⑤BaSO4固体、⑧熔化的KNO3是电解质;②液态
SO3、⑥纯蔗糖(C12H22O11)、⑦酒精(C2H5OH)是非电解质; ④汞既不是电解质也不是非电解质,
故答案为:①③⑤⑧;(3)非电解质是在水溶液里或熔融状态下都不能导电的化合物,②⑥⑦属于非
电解质,故答案为:②⑥⑦;(4)醋酸在水溶液里只有部分电离,所以是弱电解质,故答案为:③。
考点:电解质与非电解质;强电解质和弱电解质的概念


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①
(写出离子方程式);②Br2+3CO32—=BrO3—+ 5Br—+3CO2↑;③BrO3—+ 5Br—+6H+=3Br2+3H2O。其中反应②中氧化剂是 ;还原剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,
然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的离子反应方程式:_ 。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸 ④裂化汽油
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下: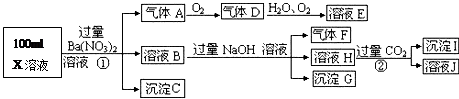
根据以上信息,回答下列问题:
(1)气体F为
(2)上述离子中,溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子是 .
(3)写出生成A的离子方程式:
(4)通常可以利用KClO在碱性条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式 .
(5)假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,且不能确定的离子只有一种。当X溶液中不能确定的离子是 ,则沉淀C的物质的量为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,_________是氧化剂, _______是还原剂,HCl表现的性质是_______和________,1mol K2Cr2O7反应转移电子的物质的量是_________。
(2)下列物质中①食盐水②NaOH ③Cu ④HCl气体⑤空气 ⑥酒精 ⑦CO2⑧KNO3属于电解质的是 (填序号,下同);属于非电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某河道两旁有甲、乙两个化工厂。它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
(1)经测定甲厂的废水明显呈酸性,故乙厂废水中所含的三种离子应该是 。
(2)如果要回收废水中的金属银,可以在废水中加入过量的一种常见金属,反应后的溶液中只含一种金属阳离子,过滤所得固体的成分是 ,要进一步分离出银,方法是 。
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出生成红褐色沉淀的离子方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)1 000 mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
(1)写出生成白色沉淀B的离子方程式:___________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能与稀硝酸反应的成分是______________________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按要求完成下列填空
(1)写出下列物质的电离方程式:
Fe2(SO4)3_____________________________________________,
NaHCO3______________________________________________;
(2)写出下列反应的离子方程式:
稀盐酸与碳酸钙反应___________________________________,
氢氧化钡溶液与稀硫酸反应_______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)D的化学式是 ,判断理由是 。
(2)写出其余几种物质的化学式:A ,B ,C 。
(3)写出实验②中有关反应的离子方程式 , 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是 。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:
①写出反应①的离子方程式 。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
(4)FeO42—在水溶液中的存在形态图如图所示。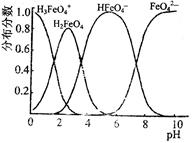
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是 。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中, 转化为 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com