
一定量的CH4与氧气燃烧后, 得到的产物只有CO, CO2和水蒸气, 且CO和CO2物质的量比为4∶3, 混合气体的质量为49. 6g, 将混合气体通过浓H2SO4后, 浓H2SO4质量增加25.2g, 则混合气体中CO2的质量为
[ ]
A. 24. 4g B. 19. 7g C. 13. 2g D. 12. 5g
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:海市奉贤区2012届高三上学期期末调研测试化学试题 题型:058
天然气在生活、生产中应用越来越广泛,如成为居民日常燃料,成为工业合成氨原料等.由天然气制取合成氨原料其主要反应为:
CH4(g)+H2O(g)→CO(g)+3H2(g)①
2CH4(g)+O2(g)→2CO(g)+4H2(g)②
CO(g)+H2O(g)→CO2(g)+H2(g)③
1.1 m3(标准状况)CH4按②式完全反应,产生H2________mol.(保留一位小数)
2.一定量的CH4、空气、水蒸气反应后得到某混合气体,各成分的质量分数分别是为O2 32%,N2 28%,CO2 22%,CH4 16%,H2 2%,此混合气体对氢气的相对密度是________(保留一位小数)
3.CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应后,得到的气体组成如下表:
列式计算该富氧空气中O2和N2的体积比V(O2)/V(N2)=________.反应中的CH4、H2O(g)和富氧空气的体积比=________.
4.某课外活动小组探究CH4和纯氧的反应,取CH4和纯氧组成的混合气体a mol通入装有9.36 g Na2O2固体的密闭容器中,用电火花不断引燃,使之高温下充分反应,恢复至常温时,容器内压强几乎为零.剩余固体成分与a的取值及CH4与O2的体积比值n之间有很多种情况,试帮助该小组同学填写如下几种情况.

查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省抚顺市六校联合体高三上学期期中考试化学试卷(解析版) 题型:填空题
氮及其化合物与人类各方面有着密切的联系。Ⅰ现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为 mL。
Ⅱ目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g) 、CO2(g)和H2O(l)的热化学方程式 。
(2)用活性炭还原法处理氮氧化物,有关反应为: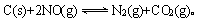
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
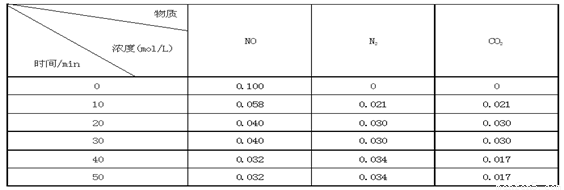
①不能作为判断反应达到化学平衡状态的依据是_______ ;(选填字母代号)
A.容器内CO2的浓度保持不变
B.v正(N2)=2 v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②前20分钟,平均反应速率v(NO)= 。v(NO)=(0.1- 0.04)/ 20 = 0.003mol·L-1· min-1
③在T0C时,该反应的平衡常数为_______(保留两位小数);
④在30 min,改变某一条件反应重新达到平衡,则改变的条件是_______ 。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
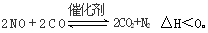
研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
|
实验编号 |
T(0C) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比 表面积(m2/g) |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
a |
b |
c |
124 |
|
Ⅲ |
350 |
d |
e |
124 |
上表中:a=_______,b=________,e=________ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊市高三第三次模拟考试理综化学试卷(A卷)(解析版) 题型:计算题
汽车内燃机工作时产生的电火花和高温会引起反应:N2(g)+O2(g)=2NO(g),导致汽车尾气中的NO和NO2对大气造成污染。
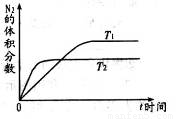
(1)在不同温度(T1,T2)下,一定量的NO分解产生N2和O2的过程中N2的体积分数随时间t变化如右图所示。根据图像判断反应N2(g)+O2(g)=2NO(g)为_________反应(填“吸热”或“放热”),随着温度的升高,该反应的平衡常数K________(填“增大”“减小”或“不变”,平衡向________移动(填“向左”“向右”或“不”)。
(2)某温度时,向容积为1L的密闭容器中充入5mol N2与2.5molO2,发生N2(g)+O2(g)=2NO(g)反应,2min后达到平衡状态,NO的物质的量为1mol,则2min内氧气的平均反应速率为_________,该温度下,反应的平衡常数K=________。该温度下,若开始时向上述容器中加入的N2与O2均为1mol,则N2的平衡浓度为_______mol/L。
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示
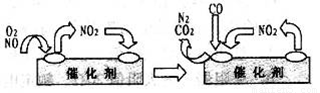 。
。
写出上述变化中的总化学反应方程式:________________________________________。
(4)用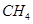 催化还原
催化还原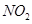 的方法也可以消除氮氧化物的污染。例如:
的方法也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
写出CH4还原NO2至N2的热化学方程式_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com