
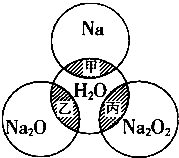
 ��ͼ��ʾ����ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������
��ͼ��ʾ����ԲȦ�ཻ����Ӱ���ֱ�ʾԲȦ�ڵ�����������ķ�Ӧ����֪�Ƽ�������������ʵ�����Ϊ0.1mol��ˮ������Ϊ100g������˵����ȷ���ǣ�������| A�� | �ס��ҡ���������������ԭ��Ӧ | |
| B�� | ��Ӧ�����ӷ���ʽΪNa+2H2O�TNa++2OH-+H2�� | |
| C�� | ����ȫ��Ӧ���ܲ���0.05molO2��ת�Ƶ���0.1mol | |
| D�� | �ס��ҡ�����ַ�Ӧ��������Һ�����������ֱ�Ϊw1��w2��w3����2w1=w2=w3 |
���� A���е���ת�ƵĻ�ѧ��Ӧ��������ԭ��Ӧ��
B���÷�Ӧ��ת�Ƶ��Ӳ��غ㣻
C���������ƺ�ˮ��Ӧʱ������������OԪ�ػ��ϼ���-1�۱�Ϊ0�ۺ�-2�ۣ��������Ƽ������������ǻ�ԭ��������һ��Ĺ�������������������һ��Ĺ�����������ԭ����
D�����ݹ�������ʵ���������Һ�����ʵ���������Һ����������������������ʽ�ж�����������Դ�С��
��� �⣺A�������ƺ�ˮ��Ӧ�����������ƣ��÷�Ӧ��û�е���ת�ƣ�������������ԭ��Ӧ����A����
B�������ӷ���ʽΪ2Na+2H2O�T2Na++2OH-+H2������B����
C���������ƺ�ˮ��Ӧʱ������������OԪ�ػ��ϼ���-1�۱�Ϊ0�ۺ�-2�ۣ��������Ƽ������������ǻ�ԭ��������һ��Ĺ�������������������һ��Ĺ�����������ԭ�������Ա���ַ�Ӧ���ܲ���0.05 mol O2��ת�Ƶ������ʵ���=0.05mol��2=0.1 mol����C��ȷ��
D���ơ������ơ��������ƺ�ˮ��Ӧ�ķ���ʽ�ֱ����£�
Na+H2O=NaOH+$\frac{1}{2}$H2������Һ���ӵ�����=m��Na��-m��H2��=2.3g-0.1g=2.2g��
Na2O+H2O=2NaOH����Һ���ӵ�����=m��Na2O��=0.1mol��62g/mol=6.2g��
Na2O2+H2O=2NaOH+$\frac{1}{2}$O2������Һ���ӵ�����=m��Na2O2��-m��O2��=m��Na2O��=6.2g
������Һ���ӵ�������С˳��Ϊ���ƣ�������=�������ƣ�
������ԭ���غ�֪��0.1mol���ơ������ơ��������ơ�����ˮ�����������Ƶ����ʵ����ֱ�Ϊ��0.1mol��0.2mol��0.2mol��ͨ�����Ϸ�����֪��0.1mol���ơ������ơ��������Ʒֱ�����ˮ������Һ�����������ֱ�Ϊ��w1=$\frac{4g}{100g+2.2g}$��w2=$\frac{8g}{100g+6.2g}$��w3=$\frac{8g}{100g+6.2g}$����2w1��w2=w3����D����
��ѡC��
���� ���⿼���Ƽ��仯�������ʼ����ʵ������㣬���ؿ���ѧ�������ж��������漰������ԭ��Ӧ�����ʵ���Ũ�ȼ����֪ʶ�㣬ע��������ƺ�ˮ��������̼��Ӧ�м������������ǻ�ԭ����Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Ͷ��ˮ�У�Na+2H2O�TNa++2OH-+H2�� | |
| B�� | ���ҽ���Һ�м������ᡢ˫��ˮ��2I-+2H++H2O2�TI2+2H2O | |
| C�� | ̼��������ϡ���ᷴӦ��CO32-+2H+�TH2O+CO2�� | |
| D�� | ��NaAlO2��Һ��ͨ�����CO2��2AlO2-+CO2+3H2O�T2Al��OH��3��+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | KNO3 | B�� | Fe2��SO4��3 | C�� | Na2CO3 | D�� | H2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4.6 g�Ҵ��к��е�C-H���ĸ���Ϊ0.6NA | |
| B�� | 34 gH2O2�к��е���������ΪNA | |
| C�� | ��״���£�11.2 LCHCl3�к��еķ�����Ϊ0.5NA | |
| D�� | 9.2gNO2��N2O4��������к��е�ԭ������Ϊ0.6NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�鲽���ʵ������ | ʵ����� |
| �۲���Һ����ɫ | ��ԭҺ��һ�������������ǣ� Cu2+��MnO4-��Fe2+ |
| ��ȡ��������Һ��������������ᣬ���������ɣ����õ���ɫ��Һ | ��ԭҺ��һ�������������ǣ� Mg2+��Ag+��Ba2+��Al3+��I-��SiO32- һ�����������ǣ� CO32-��K+ |
| ���ڢ����õ���Һ���ټ��������̼�������Һ�����������ɣ�ͬʱ������ɫ����A | ��ԭҺ�л�һ�����е������ǣ� AlO2-���ɳ���A�����ӷ���ʽΪ�� AlO2-+HCO3-+H2O=CO32-+Al��OH��3�� |
| �����ڢ�������Һ������μ�������������Һ������������Ҳ���������ɣ�ͬʱ������ɫ����B | �ܰ�ɫ����B��һ�����У� BaCO3���ܺ��У� BaSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ��FeBr3�������������������屽 | |
| B�� | ��������Ҵ��������������ɱ���������ˮ���Ʊ�������Ҵ��ķ�Ӧ���Ͳ�ͬ | |
| C�� | ��ϩ�����뱽�����е�̼̼����ͬ�������߶��ܷ����ӳɷ�Ӧ | |
| D�� |  ��CH3CH2OH��Ϊͬϵ�� ��CH3CH2OH��Ϊͬϵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe+CuSO4=FeSO4+Cu | B�� | 3CO+FeO$\frac{\underline{\;����\;}}{\;}$2Fe+3CO | ||
| C�� | AgNO3+NaCl=NaNO3+AgC1�� | D�� | 2KMnO4$\frac{\underline{\;\;��\;\;}}{\;}$K2MnO4+MnO2+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѪҺ���������˽�������� | |
| B�� | ͭ����Һ���ж���Cu2+��ʹ�����ʱ��� | |
| C�� | �����Ƶ�ˮ��Һ�׳�ˮ���������Ʊ��轺��ľ�ķ�����ȵ�ԭ�� | |
| D�� | Ư��Һ����Ч�ɷ�ΪCaCl2��Ca��ClO��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com