
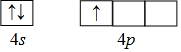
分析 (1)Ga核外电子排布式为1s22s22p63s23p63d104s24p1,不同的原子轨道能量不同,价电子排布式为4s24p1;
(2)GaAs的晶胞与金刚石晶胞相似,其中As原子位于晶胞的顶点和面心,Ga原子应全处于晶胞内部,第一电离能在主族元素中在周期中从左到右呈上升趋势,第IIA族和第VA族反常;
(3)根据VSEPR理论和杂化轨道理论判断As原子的杂化类型,H3AsO4中的非羟基氧数目多于H3AsO3,非羟基氧数目越多,酸性越强;
(4)等电子体是指原子数目相同,价电子数目也相同的粒子,NH3比较容易液化;
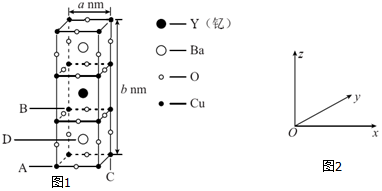
(5)①根据晶胞图结构和A、B、C三个原子的原子坐标,可求出D的原子坐标;
②根据晶胞密度公式:$ρ=\frac{z{M}_{r}}{{N}_{A}V}$可求出密度,其中z为一个晶胞的粒子数,Mr为一个粒子的相对质量,V为一个晶胞体积.
解答 解:(1)Ga元素在周期表中的位置为第四周期第IIIA族,其核外电子排布式为:1s22s22p63s23p63d104s24p1,其中不同的原子轨道能量不同,电子排布在不同原子轨道上,电子的能量也是不同的,因此共有8种不同能量的电子,其价电子排布式为:4s24p1,则排布图应为: ,
,
故答案为:8, ;
;
(2)GaAs的晶胞与金刚石晶胞相似,其中As原子位于晶胞的顶点和面心,Ga原子应全处于晶胞内部,结构决定性质,则GaAs晶体中存在共价键,由于Ga和As都含有空轨道,且含有孤电子对,可形成配位键,则还含有配位键;第一电离能在主族元素中在周期中从左到右呈上升趋势,第IIA族和第VA族反常,表现为第IIA族元素第一电离能高于第IIIA族,第VA族元素第一电离能高于VIA族元素,因此顺序为:As>Se>Ge>Ga.故答案为:共价键、配位键,As>Se>Ge>Ga;
(3)根据VSEPR理论,$As{O}_{4}^{3-}$中,成键原子数为BP=4,孤电子对数为$LP=\frac{5-2×3+3}{2}=0$,则价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,为sp3杂化,H3AsO4的酸性强于H3AsO3的原因,由于H3AsO4中非羟基氧数目为1,H3AsO3中非羟基氧数目为0,按照Pauling的半定性规则,无机含氧酸中,非羟基氧数目越多,酸性越强,另外,根据离子极化理论,H3AsO4中As的氧化态为+5,比H3AsO3中As的氧化态(+3)高,也就是说H3AsO4中As的正电性更高,对周围配位氧原子的极化能力强,导致O上电子云强烈偏向As,那么O上电子云密度降低,就会导致H+溶液解离,从而显更强的酸性.
故答案为:sp3,H3AsO4非羟基氧原子多,As的正电性更高,羟基中的O原子的电子向As偏移程度大,更容易电离出H+;
(4))[Cu(NH3)4]SO4是一种重要的配合物,与$S{O}_{4}^{2-}$互为等电子体的有CCl4(或SiCl4或CBr4或SiF4等);一定压强下,NH3比PH3容易液化,则先液化的是NH3.故答案为CCl4(或SiCl4或CBr4或SiF4等),NH3;
(5))①根据晶胞图结构和A、B、C三个原子的原子坐标分别为A为(0,0,0);B为(0,1,1);C为(1,1,0),注意在晶体化学中,原子坐标的规则为,每一个坐标的值均在[0,1)之间,且为整数,简言之,1即0,所以A、B、C其实为同一个原子坐标,都可以为(0,0,0),D为体心粒子,其晶胞参数应为$(\frac{1}{2},\frac{1}{2},\frac{1}{2})$,
故答案为:($\frac{1}{2},\frac{1}{2},\frac{1}{2}$);
②该钇钡铜氧晶体的晶胞参数分别为a nm、b nm,立方晶胞顶点原子占$\frac{1}{8}$,面心占$\frac{1}{2}$,棱上占$\frac{1}{2}$,晶胞内部粒子为整个晶胞所有,取1mol晶胞,则有NA个晶胞,一个晶胞的体积为V0,${V}_{0}={a}^{2}bn{m}^{3}={a}^{2}b×1{0}^{-21}c{m}^{3}$,1个晶胞中,含有Y的数目为1,Ba的数目为2,O的数目为$8×\frac{1}{2}+12×\frac{1}{4}=7$,Cu的数目为$8×\frac{1}{8}+8×\frac{1}{4}=3$,则1mol晶胞的质量为m=1×89+2×137+7×16+3×64=667(g),则晶胞的密度为$ρ=\frac{m}{{N}_{A}{V}_{0}}$=$\frac{667}{{N}_{A}{a}^{2}b×1{0}^{-21}}g/c{m}^{3}=\frac{6.67×1{0}^{23}}{{a}^{2}b{N}_{A}}g/c{m}^{3}$.故答案为:$\frac{6.67×1{0}^{23}}{{a}^{2}b{N}_{A}}$.
点评 本题考查结构知识,包含电子排布式,排布图,价键类型,第一电离能的递变性,价层电子对互斥理论,杂化轨道理论,酸碱性强弱比较,等电子体原理,晶胞知识.值得一提的时,本题考查的解释含氧酸酸强度,需借助大学无机化学知识解释,晶胞的原子坐标书写也属于大学无机化学知识,难度稍大.本题整体考查知识点比较综合.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 油脂都不能使溴水褪色 | |
| B. | 多糖都属于天然高分子化合物 | |
| C. | 麦芽糖在一定条件下既能发生水解反应,又能发生银镜反应 | |
| D. | 肽键是蛋白质一级结构中的主键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯、油脂、糖类、蛋白质都可以发生水解反应 | |
| B. | 乙烯和聚丙烯都能与氢气在一定条件下发生加成反应 | |
| C. | 油脂在碱性条件下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 乙烯、苯、乙醇均能使紫色的酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
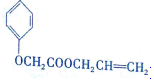 )的生产路线(反应条件略去)如图:
)的生产路线(反应条件略去)如图: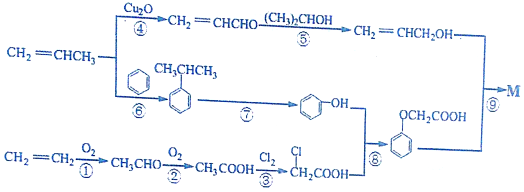
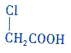 中的官能团名称是氯原子、羧基.
中的官能团名称是氯原子、羧基.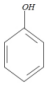 +
+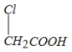 →
→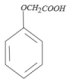 +HCl.
+HCl.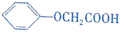 有多种同分异构体,其中既属于酚类、又属于酯类且苯环上有两个取代基的同分异构体有9种.
有多种同分异构体,其中既属于酚类、又属于酯类且苯环上有两个取代基的同分异构体有9种.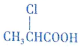 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂).
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂).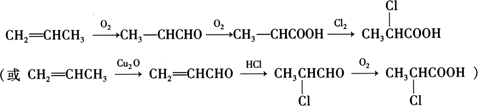 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 破坏臭氧层--氮氧化物 | |
| B. | 酸雨--二氧化碳 | |
| C. | 水体富营养化--含N,P 元素多的废水 | |
| D. | 光化学烟雾--二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
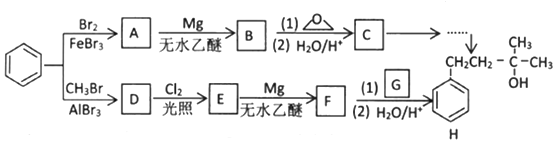
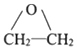 →R-CH2CH2OMgX<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→H2O/H+$\stackrel{H_{2}O/H+}{→}$R-CH2CH2OH
→R-CH2CH2OMgX<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>→H2O/H+$\stackrel{H_{2}O/H+}{→}$R-CH2CH2OH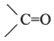 →
→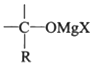 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$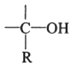
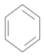 +CH3Br$→_{.}^{AlBr_{3}}$
+CH3Br$→_{.}^{AlBr_{3}}$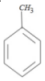 +HBr
+HBr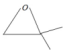
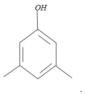
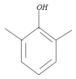 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | A电极是负极,电极上发生氧化反应 | |
| B. | 该电池总反应:2H2+O2═2H2O | |
| C. | 由于A、B两电极没有活动性差别,不能构成原电池 | |
| D. | 外电路中电流由B电极通过导线流向A电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com