
纳米钴(Co)加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) △H<0。有关说法正确的是
CH4(g)+H2O(g) △H<0。有关说法正确的是
A.纳米技术的应用,提高了催化剂的催化性能,但平衡常数不变
B.缩小容器体积,平衡向正反应方向移动CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分H2O(g)能加快正反应速率
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015广东省高二上学期期中联考化学(文)试卷(解析版) 题型:?????
下列有关试剂的保存方法,错误的是
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量的钠保存在煤油中
C.氢氧化钠溶液保存在有橡胶塞的玻璃试剂瓶中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高一上学期10月月考化学试卷(解析版) 题型:填空题
(14分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体(Cl2),而溶液的紫红色褪去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是__________,化合价没有发生变化的反应物是_____________。
(2)该反应中,发生还原反应的过程是(填化学式)___________→____________。
(3)上述反应中,1 mol氧化剂在反应中______(填“得到”或“失去”)______mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,说出NaBiO3的一个化学性质: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高一上学期10月月考化学试卷(解析版) 题型:选择题
硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成
A.S2- B.S C.SO32- D.SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江南十校高三上学期期末联考理综化学试卷(解析版) 题型:实验题
(14分)氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是 。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.已停止实验时,应先停止通入H2,后停止加热。
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化。该小组甲同学对反应后的固体产物成分提出如下假设。
假设l:含有Ca 和CaH2。
假设2:含有CaH2和CaO。
假设3:含有 。
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
实验步骤(不要求写具体操作过程) | 预期现象和结论 |
取少量固体样品,… |
(4)定量实验 测定Ca 和CaH2 混合物中CaH2 的质量分数。
①取m1g样品与水完全反应,利用如图装置测定生成的气体体积时,在 时进行收集(填字母)
a.刚开始有气泡时 b.气泡连续均匀时 c.气体经过验纯后,再收集

②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数 (天“偏高”、“偏低”“无影响”)
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要讲金属钙制备成氢化钙呢?你的观点是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省江南十校高三上学期期末联考理综化学试卷(解析版) 题型:选择题
芥子气[(ClCH2CH2)2S是一种毒气,即使嗅觉不能感受的极低浓度也会对人造成伤害,可用NaOH溶液解毒。芥子气可用以下方法制备 2CH2=CH2+S2Cl2→(ClCH2CH2)2S+S下列有关说法正确的是
A.芥子气是直线型分子 B.S2Cl2中有极性键和非极性键
C.制备反应中S2Cl2,作还原剂 D.NaOH溶液解毒原理是中和反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质露置在空气中,因发生氧化还原反应而变质的是
A.氢氧化钠 B.氯化亚铁 C.食盐 D.碳酸氢钠
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列互为同位素的是
A.613C和C60 B.白磷和红磷 C.乙醇和甲醚 D.11H和12H
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:填空题
(12分)
(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。
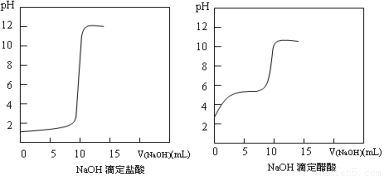
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
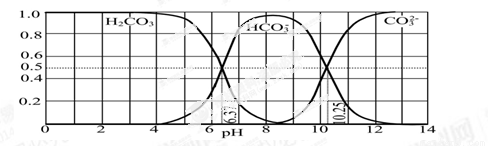
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3·H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com