
【题目】某有机物加氢反应后生成(CH3)2CHCH2OH,该有机物可能是
A.CH2=C(CH3)CH2OHB.CH3CH2CH2CHO
C.(CH3)2CHCOOHD.(CH3)3CCHO
科目:高中化学 来源: 题型:
【题目】已知下图是由常见元素组成的一些单质及其化合物之间的转化关系图。A是由单质C在D中燃烧生成的淡黄色固体。B是最常见的无色液体,常温常压下,D、F、K均为无色无刺激性气味的气体。H和I焰色反应均为黄色。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________。
(2)反应①的离子方程式为__________。
(3)反应②的化学方程式为_________。
(4)上述转化H→I的反应离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二醇(沸点:197.3℃)是一种重要的的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应 I:4NO(g)+ 4CH3OH (g)+ O2 (g)![]() 4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1
4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1
反应 II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1
反应III:CH3OOCCOOCH3 (1)+ 4H2(g)![]() HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1
HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1
(1)煤基合成气间接合成乙二醇的总热化学方程式是_________,在较低温条件下,该反应能自发进行的可能原因是_________。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应II,达到平衡时NO的体积分数33.3%,若此时向容器中通入0.4molNO,一段时间后,重新达到新平衡时NO的体积分数_________33.3% (填“>”、“=”、“<”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂活性参数:空时收率和CO选择性,表示式如下:
空时收率=![]()
CO的选择性=![]() ×100%
×100%
在不同温度下,某兴趣小组对四组其他条件都相同的反应物进行研究,经过相同时间t小时,测得空时收率、CO选择性数据如下表所示。
反应温度(℃) | 空时收率(g· mL-1· h-1) | CO的选择性(% ) |
130 | 0.70 | ① 72.5 |
140 | 0.75 | ② 71.0 |
150 | 0.71 | ③ 55.6 |
160 | 0.66 | ④ 63.3 |
下列说法正确的是_________。
A.温度升高,空时收率先增大后减少,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低,所以数据④肯定错误
C.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
D.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
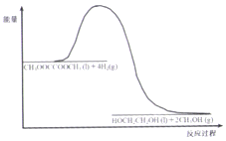
(4)120℃、常压时,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH +2CH3OH 反应过程中能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中能量变化图。_______
HOCH2CH2OH +2CH3OH 反应过程中能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中能量变化图。_______
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物中,可能含有下列离子中的几种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取三份各100 mL该溶液分别进行如下实验:
(1)在一份溶液中加入AgNO3溶液,有白色沉淀生成;
(2)在另一份溶液中加入足量的NaOH溶液并加热,收集到1.12 L气体(标准状 况下);
(3)在第三份溶液中加入足量的BaCl2溶液有沉淀生成,经称量其质量为8.6g,在该沉淀中加入足量的盐酸,沉淀部分溶解,剩余固体质量为4.66 g。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是_____________;
(2)溶液中一定存在的阴离子有___________,其物质的量浓度分别为___________,
(3)溶液中K+是否存在:_____________。若存在,它的物质的量的取值范围是 _____________。(若不存在,此空不需回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ的热量,反应方程式是2H2(g)+O2(g)===2H2O(l)。请回答下列问题:
(1)①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是_________________ 。
(3)已知下列反应的热化学方程式:
①6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
②2H2(g)+O2(g)===2H2O(g) ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是
A. 在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B. 在含大量Ba2+的溶液中:Cu2+、Na+、Cl-、OH-
C. 在强酸性溶液中:K+、Fe2+、Cl-、CH3COO-
D. 在强碱溶液中:Na+、K+、Cl-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36 号元素),对 比中学常见元素周期表思考扇形元素周期表的 填充规律,并用化学用语.回答下列问题:
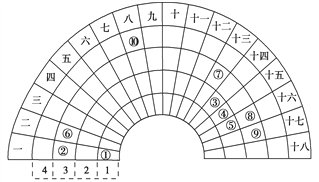
(1)若①~⑩分别代表十种元素,则⑧代表的元素在常见周期表中的位置是____________
(2)比较元素最高价氧化物对应水化物的碱性:②_____________⑥(填“>”或“<”)
(3)写出一种由①、④、⑤三种元素形成的常见离子化合物:___________,设计一个简单的实验检验其阳离子的存在:___________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
(5)①、③、⑤三种元素形成的18 电子结构的化合物是近年来燃料电池研究领域的新宠,写出用它作燃料,②的最高价氧化物对应的水化物作电解质的燃料电池的负极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下将CO2气体缓缓地通入到含2 mol KOH、1 mol Ba(OH)2和2 mol KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述正确的是

A.A~B段和C~D段发生的反应相同
B.B~C段反应的离子方程式是A1O2-+2H2O+CO2=Al(OH)3↓+HCO3-
C.V=134.4 L,n=3mol
D.D点所得溶液中离子浓度的关系为:c(K+)>c(CO32-)>c(OH﹣)>c(HCO3-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com