
 三氯化铁是合成草酸铁的重要原料.
三氯化铁是合成草酸铁的重要原料.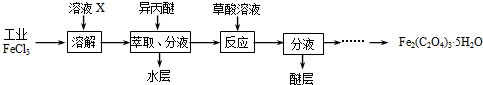


科目:高中化学 来源: 题型:
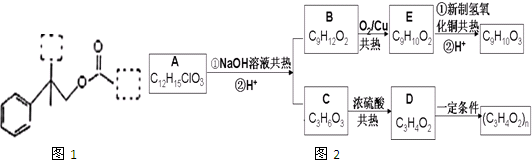
| HBr |
| NaOH |
| 水/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置A中药品应为浓硫酸 |
| B、在B-C之间应增添盛有饱和NaHCO3溶液的洗气装置,以除去氯化氢气体 |
| C、为了测得C中生成的沉淀质量,需经过过滤、洗涤、干燥、称量等操作 |
| D、只要测定装置C在吸收CO2前后的质量差,也可以确定碳酸钙的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
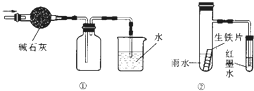
| A、提取溴水中的溴,可用加入乙醇萃取的方法 |
| B、用蒸发溶剂的方法将10%的氯化铁溶液变为20%的氯化铁溶液 |
| C、用图 ①的装置可以收集一瓶干燥的氨气 |
| D、用图 ②的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
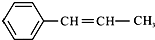 ,它可能具有的性质是( )
,它可能具有的性质是( )| A、能与H2发生加成反应,且需要1 mol H2 |
| B、分子里所有的原子都处在同一平面上 |
C、能发生加聚反应,其加聚产物可用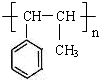 表示 表示 |
| D、该烃和苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| B、人造纤维、含成纤维和光导纤维都是有机高分子化合物 |
| C、在汽车排气管上加装“催化转化器”怒为了减少有害气体的排放 |
| D、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com