
【题目】某小组同学探究Cu和H2O2的反应。
(猜想预测)
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
(实验探究)
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10 小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________。
(继续探究)
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2+ + 4NH3 [ Cu(NH3)4] 2+ ,[ Cu(NH3)4] 2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
装置 | 序号 | 试剂a | 现象 |
| ⅱ | 20 mL 30% H2O与4 mL 5 mol/L H2SO4 混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是________(用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
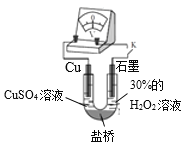
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变。
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________。
【答案】Cu+H2O2= Cu (OH)2↓ Cu+H2O2 +2H+=Cu2++2H2O 产生的铜离子催化了过氧化氢分解;或铜离子氧化了过氧化氢 加入氨水,提高了Cu的还原性 Cu(NH3)42+对H2O2分解有很好的催化作用 Cu (OH)2(aq)Cu2+(aq)+2OH-(aq),加入少量NH4Cl,NH3+H2O NH3·H2O NH4++OH-,平衡逆移,使c(NH3)增大,Cu2++4NH3 Cu(NH3)42+,使c(Cu2+)减小,Cu (OH)2(aq)Cu2+(aq)+2OH-(aq),正移,沉淀溶解,无沉淀。 酸碱性、产物微粒的种类
【解析】
本实验通过对Cu和H2O2反应的探究,得出影响Cu和H2O2反应速率快慢的因素;通过对比溶液酸碱性对反应速率的影响得出碱性条件下Cu和H2O2的反应速率较快的结论,通过对比实验考查加入氨水后,氨水对双氧水的作用和氨水对Cu2+的作用考查氨水的加入对反应的氧化性或还原性强弱的影响。
(1)向过氧化氢溶液中加入Cu,一段时间后Cu表面出现少量蓝色固体,说明有含铜离子的物质生成,故可推测反应为Cu和H2O2的反应,反应方程式为Cu+H2O2= Cu (OH)2↓;
(2)实验ii中溶液变蓝,说明Cu与H2O2在酸性条件下可以发生反应,生成Cu2+,反应的离子方程式为Cu+H2O2+2H+=Cu2++2H2O;经检验,产生的气体为氧气,说明过氧化氢大量分解,而溶液反应生成的Cu2+有催化作用,可以催化双氧水分解,产生大量气泡;
(3)向U型管双氧水一侧加入氨水,电压物明显变化,说明在双氧水中加入氨水不会影响双氧水氧化性的强弱,而向U型管硫酸铜一侧加入氨水,氨水可以和Cu2+发生反应生成四氨合铜离子,这时电压发生了变化,说明氨水的加入改变了Cu2+还原性的大小,使Cu2+的还原性增强;
(4)对比实验ii和试验iii,实验iii中产生氧气的速率更快,在实验iii中Cu和双氧水反应生成的Cu(OH)2与加入的氨水发生络合反应,产生大量的Cu(NH3)42+,对比实验ii,是Cu(NH3)42+对H2O2分解有很好的催化作用;
(5)实验iii中少量不溶物为Cu(OH)2,加入少量氯化铵后不溶物消失,原因是:Cu(OH)2(aq)Cu2+(aq)+2OH-(aq),加入少量NH4Cl,NH3+H2ONH3·H2ONH4++OH-,平衡逆移,使c(NH3)增大,Cu2++4NH3Cu(NH3)42+,使c(Cu2+)减小,Cu(OH)2(aq)Cu2+(aq)+2OH-(aq),正移,沉淀溶解,无沉淀。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有酸碱性、产物微粒的种类。


科目:高中化学 来源: 题型:
【题目】由核电荷数1~18的某些元素组成的单质 A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示的转换关系,A是地壳中含量最多的金属元素。 请回答下列问题:
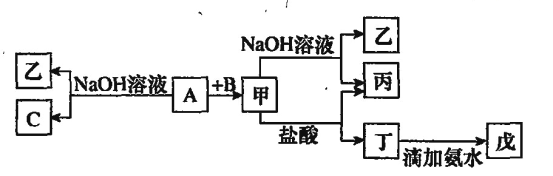
(1)写出下列物质的化学式:乙__________、丁__________、戊__________.
(2)写出甲物质在工业上的一种主要用途:__________。
(3)写出甲→乙+丙反应的离子方程式:__________。
(4)A→乙+C反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中所含氧原子的物质的量相同的是( )
A.0.3molO2和0.3molH2O
B.![]() 个
个![]() 与0.1molKMnO4
与0.1molKMnO4
C.0.1molCuSO4﹒H2O和0.1molC6H12O6
D.0.1molH2SO4和0.4NA个H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程都与能量变化有关,其中表述不正确的是( )
A.CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)燃烧热的热化学方程式为CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1
B.铝热反应会放出大量的热,因此常温下就能顺利发生
C.拆开化学键需要吸收能量,形成化学键会释放能量
D.化学电池是把化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
A.红外光谱只能检测化学键,不能检测官能团
B.核磁共振氢谱显示二甲苯只有两组吸收峰且面积比为3:2
C.煤是由苯和甲苯等有机物和无机物组成的混合物
D.石油中溶有![]() 的烷烃
的烷烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式是: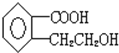 它可以通过不同的反应得到下列物质:
它可以通过不同的反应得到下列物质:
![]() 则1mol的该有机物跟足量的金属钠反应可以产生 ______
则1mol的该有机物跟足量的金属钠反应可以产生 ______ ![]() ,1mol该有机物可以跟 ______
,1mol该有机物可以跟 ______ ![]() 反应,1mol该有机物可以跟 ______ molNaOH反应。
反应,1mol该有机物可以跟 ______ molNaOH反应。
![]() 中官能团的名称是: ______ 。
中官能团的名称是: ______ 。
![]() 写出C在一定条件下反应,生成高分子化合物的化学方程式及反应类型: ______ , ______ 。
写出C在一定条件下反应,生成高分子化合物的化学方程式及反应类型: ______ , ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应正向反应过程中能量变化如图,下列说法正确的是
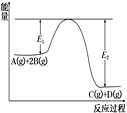
A. 该反应为吸热反应
B. 加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
C. 增大压强,平衡正向移动,K增大
D. 当反应υ正(B)∶υ正(D)=2∶1时,到达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业常用FeCl3溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜反应的离子方程式____________________
(2)某小组采取下列步骤从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液。
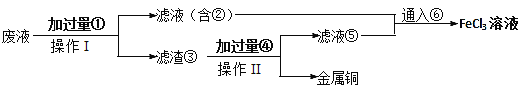
操作Ⅰ和Ⅱ的操作使用到的主要玻璃仪器有____,滤渣③含有的单质有______。通入气体⑥的化学式为______。
(3)若某腐蚀液中含1.5mol·L-1CuCl2、3.0mol·L-1FeCl2、1.0mol·L-1FeCl3,取200mL腐蚀液按上述步骤回收铜,为充分回收铜,加入①的质量最小为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL0.2mol·L-1的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )
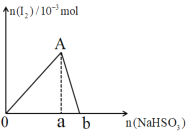
A.A点对应的I2的物质的量为1.0×10-3mol
B.0a:ab=5:1
C.当溶液中的n(I2)=5×10-4mol时,加入NaHSO3的物质的量可能为2.5×10-3mol或4.5×10-3mol
D.由ab段反应可知,氧化性I2>HSO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com