
【题目】根据题意解答
(1)某温度下,在Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=3.2×10﹣11)、AgCl(Ksp=1.8×10﹣10)三种物质中,溶解度最小的是
(2)在粗制CuSO45H2O晶体中常含有杂质Fe2+ . 在提纯时为了除去Fe2+ , 常加入氧化剂,使Fe2+氧化为Fe3+ , 下列物质最合适的是 A.KMnO4 B.H2O2 C.Cl2 水 D.HNO3
已知KMnO4氧化Fe2+时,生成Mn2+离子,试写出酸性KMnO4与Fe2+反应的离子反应方程式;然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A.NaOH B. NH3H2O C.CuCO3 D.Cu(OH)2
(3)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10﹣38 , Cu(OH)2的溶度积Ksp=3.0×10﹣18 , 通常认为残留在溶液中的离子浓度小于1×10﹣5 molL﹣1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL﹣1 , 则Cu(OH)2开始沉淀时溶液的pH为 , Fe3+完全沉淀时溶液的pH为(已知lg2=0.3,lg5=0.7),通过计算确定上述方案(填“可行”或“不可行”)
【答案】
(1)AgCl
(2)B;MnO4﹣+5Fe2++8H+═5Fe3++Mn2++4H2O;CD
(3)5;3.3;可行
【解析】解:(1)化学式相似的物质的溶度积常数越小,物质越难溶,溶解度越小,可知常温下在水中溶解能力Ca(OH)2>Mg(OH)2 , AgCl中,c(Ag+)= ![]() ≈1×10﹣5 , Mg(OH)2中,c(Mg2+)=
≈1×10﹣5 , Mg(OH)2中,c(Mg2+)= ![]() ≈1×10﹣4 , 故Mg(OH)2溶解度大,故溶解度最小的是AgCl,所以答案是:AgCl;(2)加入合适氧化剂,使Fe2+氧化为Fe3+ , 不能引入新的杂质,A、C、D中会引入杂质,只有过氧化氢的还原产物为水,不引入杂质,故只有B符合; KMnO4氧化Fe2+时,生成Mn2+离子,所以酸性KMnO4与Fe2+反应的离子反应方程式为:MnO4﹣+5Fe2++8H+═5Fe3++Mn2++4H2O,调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀,则C、D均可,A、B将铜离子转化为沉淀,不符合,
≈1×10﹣4 , 故Mg(OH)2溶解度大,故溶解度最小的是AgCl,所以答案是:AgCl;(2)加入合适氧化剂,使Fe2+氧化为Fe3+ , 不能引入新的杂质,A、C、D中会引入杂质,只有过氧化氢的还原产物为水,不引入杂质,故只有B符合; KMnO4氧化Fe2+时,生成Mn2+离子,所以酸性KMnO4与Fe2+反应的离子反应方程式为:MnO4﹣+5Fe2++8H+═5Fe3++Mn2++4H2O,调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀,则C、D均可,A、B将铜离子转化为沉淀,不符合,
所以答案是:B;MnO4﹣+5Fe2++8H+═5Fe3++Mn2++4H2O;CD;(3)Cu(OH)2的溶度积Ksp=3.0×10﹣18 , 溶液中CuSO4的浓度为3.0molL﹣1 , c(Cu2+)=3.0molL﹣1;
依据溶度积常数c(Cu2+)×c2(OH﹣)=3.0×10﹣18 , c2(OH﹣)= ![]() =10﹣18;
=10﹣18;
得到c(OH﹣)=10﹣9mol/L,
依据水溶液中的离子积c(H+)×c(OH﹣)=10﹣14 , c(H+)=10﹣5mol/L,溶液pH=5,
则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10﹣5 molL﹣1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10﹣38 , c(Fe3+)×c3(OH﹣)=8.0×10﹣38;c3(OH﹣)= ![]() =8.0×10﹣33;求的c(OH﹣)=2×10﹣11mol/L;水溶液中的离子积c(H+)×c(OH﹣)=10﹣14;c(H+)=5×10﹣4mol/L,则pH=3.3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行,
=8.0×10﹣33;求的c(OH﹣)=2×10﹣11mol/L;水溶液中的离子积c(H+)×c(OH﹣)=10﹣14;c(H+)=5×10﹣4mol/L,则pH=3.3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行,
所以答案是:5;3.3;可行.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2000年一家制药公司首次在网站上悬赏下列化合物的合成路线,悬赏金额为$100000.该化合物的结构如图1:试回答下列问题: 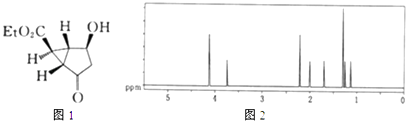
(1)上述结构式中Et表示乙基,该分子的化学式为 . 有机物归类时,母体优先顺序为酯>酸>醛(或酮)>醇等,则该分子所属类别是 .
(2)解决有机分子结构问题的手段之一是核磁共振.图2是计算机软件模拟出的该分子氢原子的核磁共振波谱图.氢原子在分子中的化学环境(原子之间相互作用)不同,其峰线在核磁共振谱图中就处于不同的位置;化学环境相同的氢原子越多,峰线的强度(高度)越大. 试参考该分子的结构简式分析谱图:该分子中共有种化学环境不同的氢原子;谱线最高者表示有个化学环境相同的氢原子;谱线最低者表示有个化学环境相同的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家将两种元素铅和的原子核对撞,获得一种质子数为118,质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为
A.57B.118C.175D.293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是周期表中的一部分,根据A﹣I的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | F | G | I | |||
3 | B | C | H |
(1)表中元素,化学性质最不活泼的是 .
(2)A﹣I元素中,非金属性最强的元素与金属性最强的元素形成的物质是 , 该物质的熔点比干冰的熔点(填“低”或“高”).
(3)比较D,E最高价氧化物的水化物酸性强弱 .
(4)G,H的氢化物沸点较高的是 , 理由是 .
(5)A,E,H组成的常见物质的电子式为 .
(6)用电子式表示E的氢化物的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
回答下列问题:

(1)甲装置中仪器a的名称是_____________________。
(2)装置乙中饱和食盐水的作用是_____________________。
(3)①制取漂白粉的化学方程式是______________________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],则产物中还混杂有物质的化学式是______。
③为提高Ca(ClO)2的含量,,可采取的措施是__________________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________(用化学方程式表示)。
(5)家庭中常用84 消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)清洁卫生。两者同时混合使用会产生有毒的氯气,写出该反应的离子方程式________________________________。
(6)实验室用MnO2跟浓盐酸反应时,当盐酸浓度低于8mol/L时就不能生成氯气。某兴趣小组在圆底烧瓶中实际加入了MnO28.7g,20mL36.5%的浓盐酸(密度1.18g/mL),充分反应后最多能够收集到_______L标准状况下的氯气(保留3位有效数字,不考虑反应过程中溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl-1.5 mol,K+和Na+共1.5 mol,Mg2+为0.5 mol,则SO42-的物质的量为
A. 1 mol B. 0.5 mol C. 0.25 mol D. 0.15 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(主要成分为Fe2O3)是一种用途广泛的颜料,用废铁屑制备铁红的流程如下:

(1)操作Ⅰ的名称是_________。
(2)检验FeCO3沉淀是否洗净的实验方法是________。
(3)加入NH4HCO3溶液的反应除了生成FeCO3沉淀,还会生成一种气体,生成气体的离子方程式为________。
(4)在空气中煅烧FeCO3的化学方程式是________,若煅烧不充分,产品Fe2O3中会有FeO,为了避免产品中有FeO,可以采取的措施是________。
(5)称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3,求算产品中Fe2O3的质量分数,写出计算过程___。
(已知:10FeSO4+2KMnO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是

A.a点对应的溶液中:Na+、AlO2-、SO42-、NO3-
B.b点对应的溶液中:Ba2+、K+、NO3-、Cl-
C.c点对应的溶液中:Na+、Ag+、Mg2+、NO3-
D.d点对应的溶液中:Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com