
 ,所含化学键类型为离子键、共价键.向甲中滴加足量水时发生反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
,所含化学键类型为离子键、共价键.向甲中滴加足量水时发生反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.分析 A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D元素是地壳中含量最多的元素,则D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E元素是短周期元素中金属性最强的元素,则E为Na;F与G的位置相邻,G是同周期元素中原子半径最小的元素,可推知F为S元素、G为Cl元素,据此解答.
解答 解:A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,则A为氢元素;B元素原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,最外层有4个电子,则B为碳元素;D元素是地壳中含量最多的元素,则D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;E元素是短周期元素中金属性最强的元素,则E为Na;F与G的位置相邻,G是同周期元素中原子半径最小的元素,可推知F为S元素、G为Cl元素.
(1)C是氮元素,原子有2个电子层,最外层电子数为5,在元素周期表中的位置:第2周期第VA族,
故答案为:第2周期第VA族;
(2)D与E按原子个数比1:1形成化合物甲为Na2O2,其电子式为 ,所含化学键类型为:离子键、共价键,向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
,所含化学键类型为:离子键、共价键,向过氧化钠中滴加足量水时发生反应的化学方程式是:2Na2O2+2H2O═4NaOH+O2↑,
故答案为: ;离子键、共价键;2Na2O2+2H2O═4NaOH+O2↑;
;离子键、共价键;2Na2O2+2H2O═4NaOH+O2↑;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序是:S2->Cl->Na+,
故答案为:S2->Cl->Na+;
(4)用CH4、O2和NaOH的水溶液组成燃料电池,电极材料为多孔惰性金属电极.在a极通入CH4气体,b极通入O2气体,甲烷发生氧化反应,则a极是该电池的负极,b为正极,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极的电极反应式为:O2+2H2O+4e-═4OH-,
故答案为:负;O2+2H2O+4e-═4OH-.
点评 本题考查结构性质位置关系应用,涉及电子式、离子半径比较、原电池等,侧重对知识的理解与迁移应用能力考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | IBr的电子式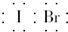 | B. | HClO的结构式为H-O-Cl | ||
| C. | HIO各原子都满足8电子结构 | D. | NaBr的形成过程可以表示为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部正确 | B. | ①② | C. | ②③ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯的单体是CH2═CHCl | |
| B. | 聚乙烯的链节是CH2═CH2 | |
| C. | 通过加聚反应得到的聚乙烯属于天然高分子化合物 | |
| D. | 聚乙烯的产量是衡量一个国家石油化工发展水平的标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
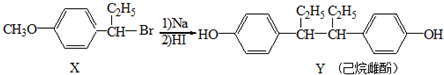
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y不能与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 1mol化合物Y可消耗3mol溴水发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的分子式:SiO2 | B. | 甲基的电子式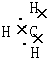 | ||
| C. | 水分子的结构式:H-O-H | D. | Na2O2中阴,阳离子数之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>② | B. | ①=② | C. | ①<② | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸、纯碱、胆矾、铜 | B. | 硫酸、烧碱、小苏打、纯碱 | ||
| C. | 盐酸、乙醇、氯化钠、碘酒 | D. | 醋酸、漂白粉、石灰石、二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com