
【题目】已知:A、D、E、H的焰色反应均呈黄色;G能使带火星的木条复燃;溶 液B中加入AgN03溶液产生浅黄色沉淀;溶液H中加AgN03溶液产生白色沉淀。在一定条件下,各物质可发生如下图所示的变化:
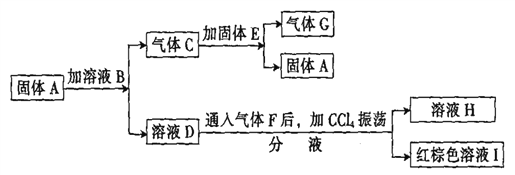
(1)写出A、B的化学式:A __________、 B _________。
(2)写出C和E反应的化学方程式:_________。
(3)写出F通人D溶液反应的离子方程式:_________。
(4)溶液H中加AgN03溶液反应的离子方程式为:_________。
【答案】 Na2CO3 HBr 2CO2+2Na2O2=2Na2CO3+O2 Cl2+2Br-=2Cl-+Br2 Ag+ + Cl-=AgCl↓
【解析】A、D、E、H的焰色反应均呈黄色,均含有Na元素;气体G能使带火星的木条复燃,则G为O2;气体C与固体E反应生成固体A与氧气,则C为CO2、E为Na2O2、A为Na2CO3,溶液B中加AgNO3溶液产生浅黄色沉淀,则溶液B中含Br-;溶液H中加AgNO3溶液产生白色沉淀,则溶液H中含Cl-;结合转化关系可知,B为HBr,D为NaBr,F为Cl2,H为NaCl,I为Br2;
(1)由上述分析可知,固体A、溶液B中溶质的化学式分别为Na2CO3,HBr;
(2)气体C和固体E反应为2CO2+2Na2O2=2Na2CO3+O2;
(3)气体F和溶液D反应的离子方程式为:2Br-+Cl2=Br2+2Cl-;
(4)NaCl溶液中加AgN03溶液生成AgCl白色沉淀,发生反应的离子方程式为Ag+ + Cl-=AgCl↓。


科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验.测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度.
实验原理:2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
实验装置:
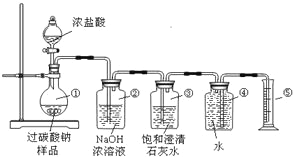
交流与讨论:
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度.
(1)装置②的作用是_________________。
(2)装置③的作用是:__________________。
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于_______________g。
Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度.但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是_________________;(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7g.则该样品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 1L 0.1 molL-1的氨水中有0.1![]() 个NH4+
个NH4+
B. 标准况下,22.4L盐酸含有![]() 个HCl分子
个HCl分子
C. 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为0.5 ![]()
D. 标准状况下,6.72 LN02与水充分反应转移的电子数目为0.2 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
(1)将有机物A置于O2流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗O26.72L(标准状况下),则该物质中各元素的原子个数比为________________。
(2)用质谱仪测定该有机化合物的相对分子质量,该物质的分子式是_____________。
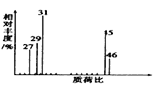
(3)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。经测定,有机物A的核磁共振氢谱示意图如下右图,则A的结构简式为________________。

(4)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式:____________。
(5)下列物质都是有机化合物,其中C8H10为一取代芳烃,且F不含甲基,转化关系如下:
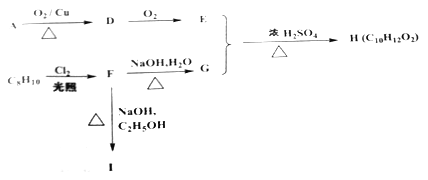
①请写出由F生成I的化学方程式:_____________。
②与H的官能团相同,且苯环上只有一取代的同分异构体共有_________种(不包括H),写出其中任意一个能发生银镜反应的有机物的结构简式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S 常用作皮革脱毛剂,工业上用反应 Na2SO4 +2C![]() Na2S+2CO2↑ 进行制取。
Na2S+2CO2↑ 进行制取。
完成下列填空:
(1)硫元素在周期表中的位置为______________。上述反应中涉及的各元素中原子半径最小的是
__________(填元素符号)。写出硫化钠的电子式:___________。
(2)用上述反应中涉及的元素,写出一个含有非极性键的化合物的化学式。 _____________
(3)写出一个能比较 S 和 O 非金属性强弱的化学事实。________________________________
(4)在 2L 的容器内发生上述反应,2 小时内共生成 78 g 硫化钠,则这段时间内用二氧化碳表示的平均反应速率为______________mol/(L·h) 。
(5)将硫化钠溶液滴入氯化铝溶液中,产生白色沉淀,同时有臭鸡蛋气味的气体生成,用平衡移动原理解
释上述现象。
__________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com