
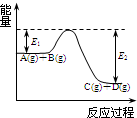
 (1)反应A(g)+B(g)
(1)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题:| 0.6mol/L |
| 2.4mol/L |
| 0.6×0.6 |
| 0.4×1.8 |
| 1 |
| 2 |
| 2×2 |
| 2×(a-2) |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
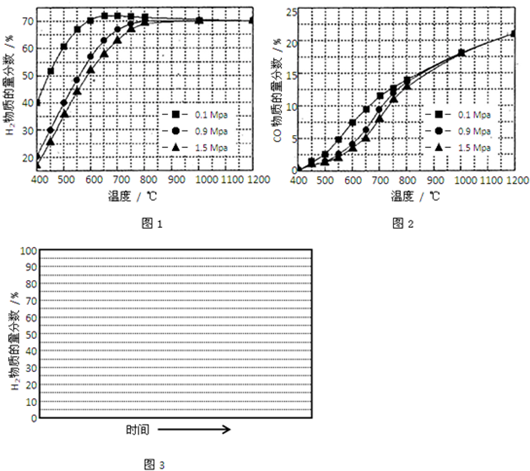
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
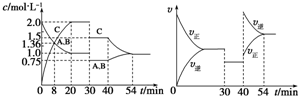 某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示,下列说法中正确的是( )
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如图所示,下列说法中正确的是( )| A、30~40min该反应使用了催化剂 | B、反应方程式中的x=1,正反应为吸热反应 | C、30min时降低压强,40min时升高温度 | D、8min时反应第一次达到平衡 |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年广东省清远市英德中学高一(上)第三次周测化学试卷(解析版) 题型:解答题
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题: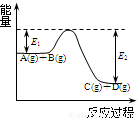
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com