
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 | |
| C. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是二氧化硫 | |
| D. | 浓H2SO4可以用铝制容器贮存,说明常温下铝与浓H2SO4不反应 |
分析 A.二氧化硫具有还原性,但二氧化硫不与浓硫酸反应,可用浓硫酸干燥二氧化硫;
B.胃酸中含盐酸,硫酸钡不溶于盐酸;
C.具有强氧化性的气体均能使品红溶液褪色,该气体不一定是二氧化硫;
D.常温下铝与浓硫酸是钝化现象,阻止了反应的继续进行,不是不反应.
解答 解:A.同种元素的不同价态之间若发生氧化还原反应,遵循价态归中不交叉,SO2中S显+4价,浓硫酸硫酸中S显+6价,无中间价态,所以SO2虽具有还原性气体,但不能被浓硫酸浓硫酸氧化,可用浓硫酸干燥二氧化硫,故A错误;
B.胃酸中含盐酸,硫酸钡不溶于盐酸,则医疗上可用硫酸钡作X射线透视肠胃的内服药,故B正确;
C.臭氧、氯气等气体也能够使品红溶液褪色,所以该气体不一定为二氧化硫,故C错误;
D.由于浓硫酸和铝在常温下发生钝化,阻止了反应的继续进行,所以常温下浓H2SO4可以用铝制容器贮存,不是二者不反应,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及浓硫酸的性质、物质漂白性、钝化现象等知识,明确常见元素及其化合物性质为解答关键,试题有利于提高学生的分析、理解能力及灵活应用能力.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的浓度一定降低 | B. | 正反应速率一定大于逆应速率 | ||
| C. | 使用了合适的催化剂 | D. | 生成物的百分含量增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
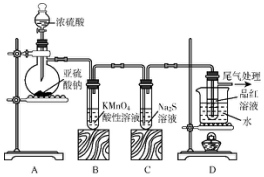
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有脱水性 | |
| B. | 浓硫酸具有吸水性 | |
| C. | 浓硫酸稀释放热 | |
| D. | 气体在水中的及其随温度升高而减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
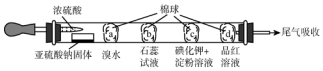
| 选项 | 现象 | 解释和结论 |
| A | a处橙色褪去 | 还原性:Br->SO2 |
| B | b处先变为红色后褪色 | SO2能与H2O反应,且有漂白性 |
| C | c处变为蓝色 | SO2具有一定的氧化性 |
| D | d处红色褪去 | SO2具有漂泊性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com