
| A. | SO2能使溴水褪色,体现其漂白性 | |
| B. | NOx、CO2、PM 2.5颗粒都会导致酸雨 | |
| C. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| D. | 等质量的NaHCO3按a、b两种途径完全转化,途径a比途径b消耗更多的盐酸 途径a:NaHCO3 $\stackrel{△}{→}$Na2CO3 $\stackrel{盐酸}{→}$CO2;途径b:NaHCO3$\stackrel{盐酸}{→}$CO2 |
分析 A.二氧化硫具有还原性能够被溴水氧化;
B.PM2.5是造成灰霾天气的“元凶”之一,与酸雨无关,二氧化碳不是形成酸雨的物质;
C.钠钾合金导热性强;
D.发生如下反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3+2HCl═2NaCl+CO2↑+H2O;NaHCO3+HCl═NaCl+H2O+CO2↑,设碳酸氢钠为2mol,第一份加热生成二氧化碳的物质的量:1mol的二氧化碳,与盐酸反应生成二氧化碳的量为1mol,消耗盐酸为2mol;而第二份,生成二氧化碳为2mol,消耗盐酸为2mol,由此分析解答
解答 解:A.SO2能使溴水褪色,是因为发生氧化还原反应,体现其还原性,不是漂白性,故A错误;
B.酸雨是指溶液pH小于5.6的雨水,正常雨水的pH约为5.6,二氧化硫、氮氧化物等物质是形成酸雨的重要物质,二氧化碳排放过多会引起温室效应,不是形成酸雨的气体,PM2.5是造成灰霾天气的“元凶”之一,所以CO2、PM2.5颗粒都不会导致酸雨,故B错误;
C.钠钾合金导热性强,可用于快中子反应堆的热交换剂,故C正确;
D.2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,Na2CO3+2HCl═2NaCl+CO2↑+H2O;NaHCO3+HCl═NaCl+H2O+CO2↑,设碳酸氢钠为2mol,第一份加热生成二氧化碳的物质的量:1mol的二氧化碳,与盐酸反应生成二氧化碳的量为1mol,消耗盐酸为2mol;而第二份,生成二氧化碳为2mol,消耗盐酸为2mol,所以消耗盐酸一样多,放出二氧化碳分别是1mol和2mol,故D错误;
故选C.
点评 本题考查了物质性质、酸雨形成、物质应用、化学方程式计算等知识点,注意定量计算的分析方法,题目难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
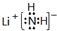 .
.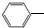 CH2CH3(g)?催化剂
CH2CH3(g)?催化剂 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黏土 | B. | 纯碱、石灰石、石英砂 | ||
| C. | 黏土、石灰石 | D. | 二氧化硅、硅酸钙、硅酸铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入酚酞显红色的溶液:Na+、NH4+、NO3-、Cl- | |
| B. | 0.1 mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO4 2-、Cl- | |
| C. | 0.1 mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| D. | c(H+):c(OH-)=1012mol•L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 0.1 mol•L-1 CH3COOH溶液加水稀释后,溶液中c(OH-)、CH3COOH浓度均减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 | |
| B. | NaCl$\stackrel{通电}{→}$Na$\stackrel{TiCl_{4}溶液}{→}$ Ti | |
| C. | MgCl2•6H2O $\stackrel{△}{→}$MgCl2$\stackrel{通电}{→}$Mg | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

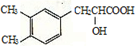 +NaHCO3
+NaHCO3
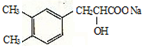 +CO2↑+H2O.
+CO2↑+H2O.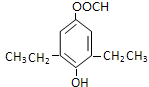 或
或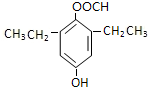 .
.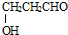 ,请写出以
,请写出以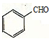 、CH3CH2OH为原料合成
、CH3CH2OH为原料合成 的路线流程图(无机试剂可任选).合成路线流程图如下:
的路线流程图(无机试剂可任选).合成路线流程图如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
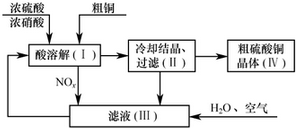
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
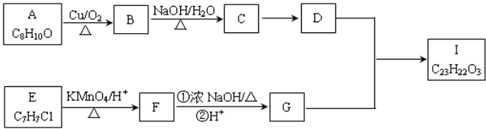
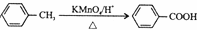
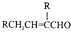
 .
. .
.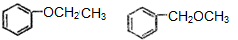 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com