
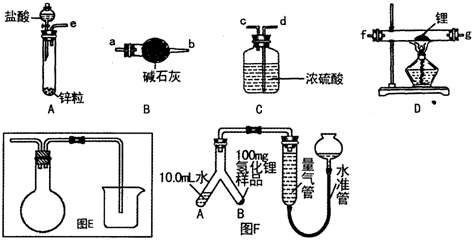
���� ��1���Ʊ�LiH������Ҫ�Ʊ�������﮷�����Ӧ��LiH�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ������Ʊ��õ�������������﴿��������Aװ���Ʊ�������������B�еļ�ʯ�ҳ�ȥ�����е��Ȼ����ˮ������ͨ��װ��D�м��Ⱥ�﮷�Ӧ�����⻯ﮣ��������װ��C��ֹ�����е�ˮ�����Ͷ�����̼����װ��D�����ɵ��⻯﮷�����Ӧ��
��2��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ�����ʯ�����л������ܽ����л��ܼ��ױ��з�����
��3��װ��E�����ռ�H2�����õ�������ƿ���ռ����������Ը�����ˮ���������װ�ã������ܶ̽�������
��4������װ���ص���⻯����ˮ��Ӧ�����������з�����
��5��������������ڷ�Ӧǰ��Һ��
��6����������������=������������������ܶ�����������������ٽ���⻯���ˮ��Ӧ����ʽ�����ˮ��Ӧ����ʽ������⻯﮵�����������������Ʒ���⻯﮵Ĵ��ȣ�
��� �⣺��1���Ʊ�LiH������Ҫ�Ʊ�������﮷�����Ӧ��LiH�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ������Ʊ��õ�������������﴿��������Aװ���Ʊ�������������B�еļ�ʯ�ҳ�ȥ�����е��Ȼ����ˮ������ͨ��װ��D�м��Ⱥ�﮷�Ӧ�����⻯ﮣ��������װ��C��ֹ�����е�ˮ�����Ͷ�����̼����װ��D�����ɵ��⻯﮷�����Ӧ��װ������˳��Ϊ��e��a��b��f��g��d��װ��B�м�ʯ���������ƺ��������ƵĻ�����������ˮ�ɷ�Ӧ���������ƿ�������������������ܷ�Ӧ�����Ը�װ�õ�����������ˮ�����Ͳ����Ȼ������壬
�ʴ�Ϊ��e��a��b��f��g��d����ȥ�����е�ˮ���Ȼ��⣻
��2��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ�����ʯ�����л������ܽ����л��ܼ��ױ��У�������Ŀ���dz�ȥﮱ����ʯ����
�ʴ�Ϊ����ȥﮱ����ʯ����
��3��װ��E�����ռ�H2�����õ�������ƿ���ռ����������Ը�����ˮ���������װ�ã������ܶ̽�������װ��ͼΪ ��
��
�ʴ�Ϊ�� ��
��
��4�������⻯����ˮ��Ӧ���������������ж���Ʒ��ˮ�Ƿ���ȫ��Ӧ�����Թ۲����ݲ��ٲ������ұߵ���������Һ�棬�����ٱ仯��������ȫ��Ӧ��
�ʴ�Ϊ�����ݲ��ٲ������ұߵ���������Һ�棬�����ٱ仯��
��5��������������ڷ�Ӧǰ��Һ���=254.4mL-10.0mL=244.4mL���ʴ�Ϊ��244.4��
��6����Ӧ������������=244.4ml��0.09mg/ml=21.996mg���⻯���Ʒ�г�����δ��ȫ��Ӧ��ﮣ�
��LiH������ΪX��������������ΪY����﮵�����=100mg-X�����ˮ��Ӧ������������Ϊ21.996mg-Y
LiH+H2O=H2��+LiOH
8 2
X Y
X=4Y
2Li+2H2O=2LiOH+H2��
14 2
100mg-X 21.996mg-Y
2��100mg-X��=14��21.996mg-Y��
���X=71.96mg
Y=17.99mg
��Ʒ���⻯﮵Ĵ���=$\frac{71.96mg}{100mg}$��100%=71.96%��
����Ʒ���⻯﮵Ĵ���Ϊ71.96%��
���� ���⿼����������ɵ�ʵ��̽�����������̷����жϣ�ʵ��װ�õ�����˳��ͷ����жϣ���ѧ����ʽ���������Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢޢ� | B�� | �٢ڢۢ� | C�� | �٢ڢ� | D�� | �٢ڢۢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

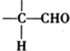 $\stackrel{ϡ����������Һ}{��}$
$\stackrel{ϡ����������Һ}{��}$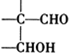 -CHO+
-CHO+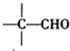 +NaOH��Ũ����
+NaOH��Ũ����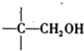 +
+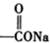
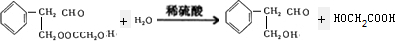
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AlN��ͨ����ӦAl2O3+N2+3C$\frac{\underline{\;����\;}}{\;}$2AlN+3CO�ϳɣ��÷�Ӧ�У�ÿ����1 mol AlN��ת��1.5 mol���� | |
| B�� | CsICl2��һ�ּ�����Ķ�±������������ڻ�ѧ��Ӧ�мȿɱ����������ֿɱ��ֻ�ԭ�ԣ�����CsICl2��Һ��ͨ��Cl2���е��ʵ����� | |
| C�� | ��ӦA+3B�T2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��v��A��=0.15 mol/��L•s������v��B��=0.6 mol/��L•s������v��C��=0.4 mol/��L•s������v��D��=0.45 mol/��L•s�����÷�Ӧ���еĿ���˳��Ϊ�ܣ���=�ڣ��� | |
| D�� | AlCl3��Һ�м������ϡ��ˮ����Ӧ�����ӷ���ʽΪ��Al3++4NH3•H2O�TAlO2-+4NH4++2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
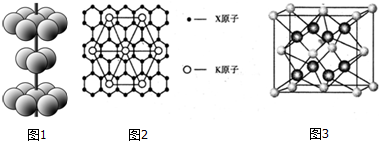
 ij�ּ���Ⱦ�ϣ�Ӧ���ڿɵ�гȾ�ϼ�����������C��H��O����Ԫ����ɣ��������ģ����ͼ��ʾ�������й�������ȷ���ǣ�������
ij�ּ���Ⱦ�ϣ�Ӧ���ڿɵ�гȾ�ϼ�����������C��H��O����Ԫ����ɣ��������ģ����ͼ��ʾ�������й�������ȷ���ǣ�������| A�� | �ۢ� | B�� | �٢� | C�� | �ڢۢ� | D�� | �٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
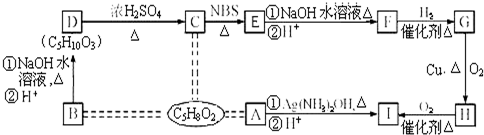
 ��
��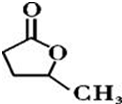 ��
��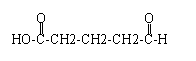 ��
��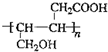 ��
��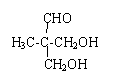 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� ���� | IA | 0 | ||||||
| 1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
 ��
�� ���ɢڡ�������Ԫ���γɵ�һ��������������ЧӦ�������ʽΪ��
���ɢڡ�������Ԫ���γɵ�һ��������������ЧӦ�������ʽΪ�� ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ����Ʒ | ��Һ�¶� | �к��� | |||
| t1 | t2 | ��H | |||
| �� | 50 mL 0.50 mol•L-1 NaOH��Һ | 50 mL 0.55 mol•L-1 HCl��Һ | 20�� | 23.2�� | |
| �� | 50 mL 0.50 mol•L-1 NaOH��Һ | 50 mL 0.55 mol•L-1 HCl��Һ | 20�� | 23.4�� | |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com