
 卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题
卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题
分析 (1)核磁共振氢谱中峰值数等于有机物中氢原子的种类数,核磁共振氢谱中只给出一种峰,说明该分子中只有1种H原子,结构对称,如含2个峰,则应为CH3CHBr2;
(2)①溴乙烷沸点低,溴乙烷易挥发,用水浴加热热均匀,减少溴乙烷的损失;
②溴乙烷在NaOH乙醇溶液中发生的是消去反应生成乙烯;乙烯中含有乙醇,可以用水除去乙醇;乙烯能使高锰酸钾溶液褪色.
解答 解:(1)核磁共振氢谱中只给出1种峰,说明该分子中只有1种H原子,则A的结构简式为CH2BrCH2Br,B应为CH3CHBr2,有2个峰,
故答案为:CH2BrCH2Br;2;
(2)①便于控制温度,受热均匀,减少溴乙烷的损失;
故答案为:便于控制温度,受热均匀;
②溴乙烷在NaOH乙醇溶液中发生的是消去反应生成乙烯,实验中需要检验的产物是乙烯,乙烯中含有乙醇,可以用水除去乙醇;乙烯能使高锰酸钾溶液褪色,
故答案为:乙烯; 除去乙烯中的乙醇,防止干扰乙烯的检验; 酸性高锰酸钾溶液紫红色褪去.
点评 本题考查有机物的推断,侧重氯代烃的考查,注意把握有机物的结构与性质的关系,把握卤代烃的性质的检验方法,难度不大,有利于培养学生的分析能力和实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
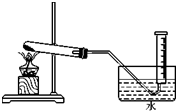 为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡,再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变反应条件可以改变该反应的限度 | |
| B. | 达到平衡后,SO3、SO2、O2在密闭容器中共存 | |
| C. | 达到平衡后,反应停止,正、逆反应速率都等于零 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2F+的电子式: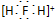 | |
| B. | 铝离子的结构示意图: | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | 丙烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质C和D的浓度相等 | |
| B. | 混合气体的平均相对分子质量不再变化 | |
| C. | A的物质的量浓度不再变化 | |
| D. | 物质B,C,D的物质的量之比为2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com