
| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |
分析 原子序数依次增大的A、B、C、D、E五种前20号的主族元素,已知A的氧化物能引起温室效应,A为C元素;E的单质能与水剧烈反应且同主族中存在金属和非金属元素,则E为Na或K,其中A和C、B和D分别在同一主族,则C为Si,可知E只能为K,由它们原子的最外层电子数之和为20,设B的最外层电子数为x,则4×2+x×2=20,解得x=6,则B为O,D为S,然后结合元素周期律及元素化合物知识来解答.
解答 解:原子序数依次增大的A、B、C、D、E五种前20号的主族元素,已知A的氧化物能引起温室效应,A为C元素;E的单质能与水剧烈反应且同主族中存在金属和非金属元素,则E为Na或K,其中A和C、B和D分别在同一主族,则C为Si,可知E只能为K,由它们原子的最外层电子数之和为20,设B的最外层电子数为x,则4×2+x×2=20,解得x=6,则B为O,D为S,
A.B的氢化物的沸点比D的氢化物要高,与水中含氢键有关,与O的非金属性强无关,故A错误;
B.二氧化碳、二氧化硅中化学键相同,晶体类型分别为分子晶体、原子晶体,故B错误;
C.非金属性D大于C,则C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性弱,故C错误;
D.根据元素周期律,K的金属性大于Na,则推测E在氧气中燃烧时可能生成E2O2、EO2等物质,故D正确;
故选D.
点评 本题考查原子结构及元素周期律,为高频考点,把握元素在周期表的位置、元素化合物知识推断元素为解答的关键,侧重分析与推断能力的考查,注意原子结构及元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
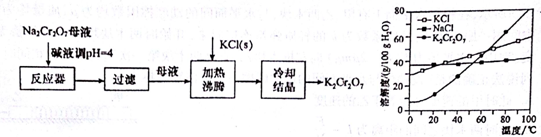
 Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.
Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m:n=2:1 | B. | m=2x | C. | x:m:n=1:2:1 | D. | m=2x+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(2H)原子核内有1个质子 | |
| B. | 1H与2H是不同的核素 | |
| C. | 1H218O与2H216O的相对分子质量相同 | |
| D. | 1H2O与2H2O互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
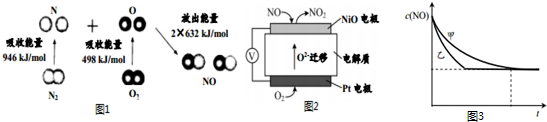
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②⑤ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com