
| A. | c(O2)=0.2 mol/L | B. | c(SO2)=0.25 mol/L | ||
| C. | c(SO2)+c(SO3)=0.3 mol/L | D. | c(SO2)=c(SO3)=0.15 mol/L |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于该值,所以SO2小于 0.4mol/L,O2小于0.2mol/L,故A错误;
B、c(SO2)<0.4mol/L,而c(SO2)=0.25 mol/L<0.4mol/L,故B正确;
C、根据硫守恒c(SO2)+c(SO3)=0.4 mol/L,故C错误;
D、根据硫守恒c(SO2)+c(SO3)=0.4 mol/L,而c(SO2)=c(SO3)=0.15 mol/L,则c(SO2)+c(SO3)=0.3 mol/L,故D错误;
故选B.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-氯丁烷与氢氧化钠、乙醇在加热条件下的消去反应 | |
| B. | 乙烯通入溴水中的加成反应 | |
| C. | 灼热的铜丝插入足量乙醇中的氧化反应 | |
| D. | 苯酚与足量的氢气在一定条件下的加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12 g铁与足量浓硫酸反应 | |
| B. | 0.12g镁与足量盐酸反应 | |
| C. | 0.02mol钠与足量水反应 | |
| D. | 0.01mol铝与足量氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 生成1 molHF气体放出的热量为270 KJ | |
| B. | H2(g)+F2(g)→2HF(l)+270 KJ | |
| C. | 反应物的总能量大于生成物的总能量 | |
| D. | 该反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 常温下,碳酸的第一、二步电离常数之比为K1:K2=102.9 | |
| B. | NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | NH4HCO3溶液中:c(NH4+)+c(NH3•H2O)+c(H+)=c(CO32-)+c(H2CO3)+c(HCO3-)+c(OH-) | |
| D. | 常温下,NH3•H2O的电离常数大于H2CO3的第一步电离常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Cl- | B. | Ca2+、NH4+、HCO3-、NO3- | ||
| C. | NO3-、Fe2+、Ca2+、H+ | D. | Mg2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解成CaO(s)和CO2(g),△S<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,平衡向正方向移动 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 1 | 1 | 3 |
| 混合物的体积/g | 3.76 | 4.70 | 8.46 |
| 硫酸浓液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成一氧化碳的物质的量/mol | 0.03 | 0,0375 | 0.03 |
| A. | 样品中碳酸钾和碳酸氢钾的物成的量之比为1:2 | |
| B. | 样品中碳酸钾和碳酸氢钾的物质的量之比为2:3 | |
| C. | 所用硫酸的物质的量浓度为l.5mol•L-1 | |
| D. | 所用嫌酸的物质的量浓度为0.75mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

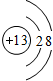 ,MgO的电子式
,MgO的电子式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com