
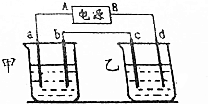
 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】分析 (1)若b极上有红色物质生成,说明甲池电解质是硫酸铜,b极上生成铜,b是阴极,B是原电池的负极,则A是正极;
(2)若乙池产生的气体明显多于甲池,说明乙池是电解饱和氯化钠溶液,则甲池电解质是硫酸铜;
(3)若乙池中加入酚酞后d极溶液先变红,说明氢离子放电生成氢气,所以d极是阴极,B是原电池的负极,则A是正极;
(4)若d极气体能使淀粉碘化钾试纸变蓝,说明d极是氯离子放电生成氯气,所以d极为阳极,则B极是正极,则A是负极,所以a极是阴极;
(5)若电子有c极流向b极,则c极是阳极,电源A极是正极;
(6)若反接电源,再通电相同时间,则盛装硫酸铜溶液,阳极铜完全放电生成铜离子,而阴氢离子放电生成氢气,则电解池pH 增大,盛装氯化钠溶液就是电解氢氧化钠溶液,也就是电解水,电解池pH 增大.
解答 解:(1)若b极上有红色物质生成,说明甲池电解质是硫酸铜,b极上生成铜,b是阴极,B是原电池的负极,则A是正极,故答案为:正;
(2)若乙池产生的气体明显多于甲池,说明乙池是电解饱和氯化钠溶液,则甲池电解质是硫酸铜,故答案为:硫酸铜;
(3)若乙池中加入酚酞后d极溶液先变红,说明氢离子放电生成氢气,所以d极是阴极,B是原电池的负极,则A是正极,故答案为:正;
(4)若d极气体能使淀粉碘化钾试纸变蓝,说明d极是氯离子放电生成氯气,所以d极为阳极,则B极是正极,则A是负极,所以a极是阴极,故答案为:阴;
(5)若电子有c极流向b极,则c极是阳极,电源A极是正极,故答案为:阳;正;
(6)若反接电源,再通电相同时间,则盛装硫酸铜溶液,阳极铜完全放电生成铜离子,而阴氢离子放电生成氢气,则电解池pH 增大,盛装氯化钠溶液就是电解氢氧化钠溶液,也就是电解水,电解池pH 增大,故答案为:增大;增大.
点评 本题是一道电解原理知识的题目,要熟记电解池的工作原理,学生要清楚电解池中,阳极是还原性强的阴离子先放电,阴极是氧化性强的阳离子先放电,比较容易.


科目:高中化学 来源: 题型:选择题
| A. | ClO2的分子结构呈V型,属非极性分子 | |
| B. | ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子数目表示)是Cl2的5倍 | |
| C. | ClO2、Cl2的稀溶液用于环境消毒,对人体无任何危害 | |
| D. | 常用Na2SO3在H2SO4存在条件下,还原NaClO3来制ClO2,化学方程式为:Na2SO3+2NaClO3+H2SO4═2Na2SO4+2ClO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结 论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加人新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 甲烷和氯气混合后在光照下,颜色逐渐褪去 | 甲烷和氯气发生了化合反应 |
| D | 向饱和Na2CO3中通人足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NaHCO3溶液与NaOH反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| D. | 向氢氧化钡溶液中通入少量二氧化硫气体:2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1L,2mol/L的(NH4)2CO3溶液中含有CO32-数目为0.2NA | |
| B. | 加热条件下,MnO2与浓盐酸反应生成7.1gCl2,转移的电子数目为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| D. | 常温下,1L0.1mol•L-1的CH3COOH溶液中含有的H+数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com