
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用图所示装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。
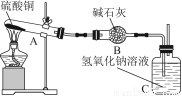
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B. 3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
元素性质元素编号
ABCDEFGH
原子半径(nm)0.1020.1100.1170.0740.0750.0710.0990.077
最高化合价+6+5+4+5+7+4
最低化合价-2-3-4-2-3-1-1-4
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2 是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是________________;
(2)C和H的气态氢化物的稳定性强弱关系为______________(用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是_____________________________________。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3===2________+CO2
横线上某盐的化学式应为________。
(5)在一密闭容器中发生反应2AD2+D2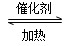 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。在下列方框内绘出该实验方案装置图。

查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列解释相关问题或实验的离子方程式不正确的是( )
A.NaClO溶液呈碱性:ClO-+H2O HClO+OH-
HClO+OH-
B.向沸水中滴加饱和FeCl3溶液制胶体:Fe3++3H2O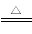 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
C.粗盐提纯中除去Mg2+:Mg2++2OH-=Mg(OH)2↓
D.工业上精炼粗铜的阴极反应:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:选择题
下列有关元素锗及其化合物的叙述中正确的是( )
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是四面体构型
C.二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳的单质都是原子晶体
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:选择题
下列化学工业有关设备、原料、反应条件配套的是 ( )
A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30 ℃~35 ℃的氨化饱和食盐水吸收CO2
B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000~5000 ℃
C.合成氨:沸腾炉、焦炭、铁触媒、500 ℃
D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000 ℃
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:实验题
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。已知乙醛在加热条件下能与新制Cu(OH)2悬浊液反应生成Cu2O。(代表酒精灯)
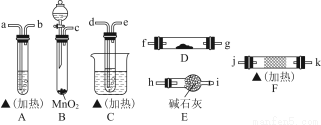
回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为 __(填仪器接口的字母编号)(加热和夹持装置已略去)。
(2)B装置的分液漏斗中液体药品是 _(填化学式)。该液体还可以与酸性KMnO4溶液反应产生相同的气体,写出该反应的离子方程式 。
(3)F装置中的固体试剂是 ,发生反应的化学方程式为 。反应一段时间后移去酒精灯,反应能继续进行,其原因是 。
(4)A装置和D装置中的实验现象分别为 、 。
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题13化学实验基础练习卷(解析版) 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g)??NH2COONH4(s) ΔH<0。
(1)如图所示装置制取氨气,你所选择的试剂是________________________。

(2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。
液体石蜡鼓泡瓶的作用是________________________________________________________________________。
②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________
(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.真空40 ℃以下烘干
③尾气处理装置如图所示。

双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[Mr(NH2COONH4)=78,Mr(NH4HCO3)=79,Mr(CaCO3)=100]
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.油脂饱和程度越大,熔点越低
B.除去C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱石灰干燥
C.蔗糖、麦芽糖、硬脂酸甘油酯酸性水解都能得到两种物质
D.麻黄碱(CHOHCHCH3NHCH3)的催化氧化产物与乙醇的催化氧化产物官能团相同
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:填空题
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-=NO↑+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:__________________________________。
(2)反应中硝酸体现了______________、______________的性质。
(3)反应中若产生0.2 mol气体,则转移的电子的物质的量是________ mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com