
����Ŀ���о������к������Ҫ��SO2��H2S����ת��������Ҫ���壮
��1����ʪ�����£�д��������SO2ת��ΪHSO3���ķ���ʽ��
��2�������е�����ɽ�������H2S��������Ӧ������SO42�� �� ������Ӧ�������仯ʾ��ͼ���£�
1mol H2S��g��ȫ��������SO42����aq�����Ȼ�ѧ����ʽΪ ��
��3���������������ӽ���Ĥȼ�ϵ�ؿ������ô�������SO2������������װ��ʾ��ͼ���£�
�����ӵ���������Ϊ������A��B����B��A������
�ڸ����ĵ缫��ӦʽΪ ��
��4��ȼú��������������Ǽ��ٴ����к�������Ⱦ�Ĺؼ���SO2�����ѳ���һ�ֹ�ҵ�������£�
���ô�����Һ����SO2����ת��ΪHSO3�� �� ��Ӧ�����ӷ���ʽ�� ��
����ʯ�������������������Ż����ճأ����п���������SO2�����ʵĻ�ѧʽ�� ��
���𰸡�
��1��SO2+H2O?H2SO3��H2SO3?H++HSO3��
��2��H2S��g��+2O2��g��=SO42����aq��+2H+��aq����H=��806.39kJ?mol��1
��3����A��B��SO2��2e��+2H2O�TSO42��+4H+
��4��H2O+2SO2+CO32���T2HSO3��+CO2��Ca��OH��2
���������⣺��1����������Ϊ������������ˮ���������ᣬ������Ϊ������ʣ����ֵ��������������������������ӣ����ӷ���ʽ��SO2+H2OH2SO3��H2SO3H++HSO3����
��2.����ͼ��֪����һ���Ȼ�ѧ��ӦΪ��H2S��g��+0.5O2��g��=S��s��+H2O��g����H=��221.19 kJmol��1��
�ڶ�����ӦΪ��S��s��+1.5O2��g��+H2O��g��=2H+��aq��+SO42����aq������H=��585.20 kJmol��1��
���ݸ�˹���ɣ���һ����ڶ�������ʽ��ӵã�H2S��g��+2O2��g��=SO42����aq��+2H+��aq����H=��806.39 kJmol��1��
���Դ��ǣ�H2S��g��+2O2��g��=SO42����aq��+2H+��aq����H=��806.39 kJmol��1
��3.���ٶ���������������Ӧ������������ԭ��Ӧ�����Զ����������ڵ缫Ϊ�������������ڵ缫Ϊ������ԭ������������������������������ƶ�����Ϊ����A��B��
���Դ��ǣ���A��B��
�ڶ��������ڸ���ʧȥ���ӷ���������Ӧ���缫��ӦʽΪ��SO2��2e��+2H2O�TSO42��+4H+��
���Դ��ǣ�SO2��2e��+2H2O�TSO42��+4H+��
��4.����̼������Һ��ͨ������Ķ�������Ӧ�������������ƺͶ�����̼�����ӷ���ʽ��H2O+2SO2+CO32���T2HSO3��+CO2��
���Դ��ǣ�H2O+2SO2+CO32���T2HSO3��+CO2��
�ڶ�������Ϊ����������ܹ�������������Һ��Ӧ�������������������ն�������
���Դ��ǣ�Ca��OH��2 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��������װ�õ���ţ�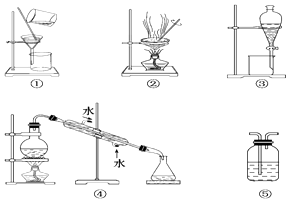
��1������Na2CO3��Һ��CH3COOC2H5��������ˮ��Һ�壩��ѡ �� ��������Ϊ ��
��2����CCl4��ȡ��ˮ�еĵ⣬ѡ �� ��������Ϊ ��
��3��������������Һ����CO2 �� ѡ �� ��������Ϊ ��
��4��������ˮ��ȡ����ˮ��ѡ �� ��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2C��s��+O2��g���T2CO��g����H=��220kJmol��1������ȼ�յ������仯ʾ��ͼ��
����˵����ȷ���ǣ� ��
A.1molC��s����ȫȼ�շų�110 kJ������
B.H2��g��+ ![]() O2��g���TH2O��g����H=��480 kJ?mol��1
O2��g���TH2O��g����H=��480 kJ?mol��1
C.C��s��+H2O��g���TCO��g��+H2��g����H=+130 kJ?mol��1
D.���ֽ�2 mol H2O��l����������Ҫ�ṩ4��462 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ��������������ȷ���ǣ�������
A.��״���£�6.72LO2��N2�Ļ�����庬�е�ԭ����Ϊ0.6NA
B.ͨ��״���£�8g O2��O3 �Ļ�����庬�еķ�������0.5NA
C.���³�ѹ�£�2mol/L��100mL MgCl2��Һ�У�����Cl�� ����Ϊ0.4NA
D.��״���£�11.2L H2����������ȫȼ�պ�õ��IJ���ķ�����Ϊ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ����������һ���Լ��ǣ� ��
A. �Ȼ�����Һ���ռ���ҺB. ���������ռ���Һ
C. ��������ˮD. ����ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤��ij������һ���������Ӽ��������� �� ��
A. ����״̬�ܵ��� B. ���нϸߵ��۵�
C. ������ˮ D. ����ˮ�ܵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����amL һ��������bmL ����������xmL ���������ͬһ�Թ�����Թܿڵ�����ˮ�У���ַ�Ӧ���Թ�������ȫ����ʧ������a��b��ʾ��x�Ĵ���ʽ�� �� ��
A. (a��b)/2B. (2a��b)/3C. (3a��b)/4D. (4a��b)/5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ����ڷ�Ӧ��14CuSO4+5FeS2+12H2O��7Cu2S+5FeSO4+12H2SO4 �� �ڸ÷�Ӧ�У� ��
A.�����е�SO ![]() ��һ��������������
��һ��������������
B.5molFeS2������Ӧ����10mol����ת��
C.����������Ӧ�ͷ�����ԭ��Ӧ��FeS2֮��Ϊ7��3
D.14mol CuSO4������5molFeS2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������幹����ͬ���ǣ� ��
A.CO2��SO2
B.CH4��CCl4
C.NH3��BF3
D.H3O+��SO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com