


科目:高中化学 来源: 题型:
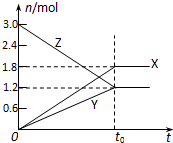 在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z?3X+2Y |
| B、达到平衡时,X、Y、Z的质量不再改变 |
| C、达到平衡时,Z的浓度为1.2mol/L |
| D、达到平衡后,反应停止,反应速率为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
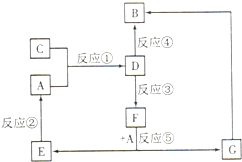 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:| 实验步骤 | 实验现象 | 写离子方程式 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 | |
| 继续通入气体 | 溶液逐渐变成无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
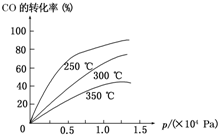 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
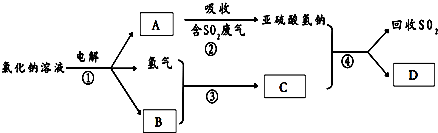
查看答案和解析>>
科目:高中化学 来源: 题型:
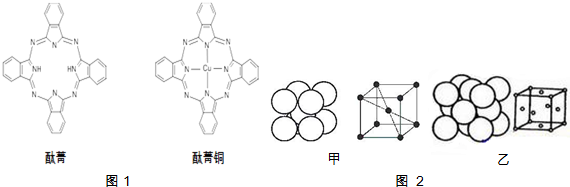
查看答案和解析>>
科目:高中化学 来源: 题型:
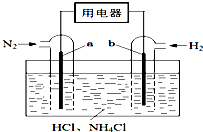 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如右图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如右图所示.下列有关分析正确的是( )| A、a为电池的负极 |
| B、通入N2一极的电极反应式为:N2+6e-+8H+═2NH4+ |
| C、电池工作一段时间后,溶液pH减小 |
| D、电流的方向是由b经用电器到a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol?L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 |
| A、可用压强或密度是否发生变化判断上述反应是否达到平衡 |
| B、实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时υ(D)为0.01mol?L-1?min-1 |
| C、由表中信息可知Q>O,并显有Q3<Q2=Q1=Q |
| D、实验Ⅰ达平衡后,恒温下再向容器中通入1mol A和1mol D,达平衡时c(D)为1.0mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com