
【题目】已知:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B.
如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
【答案】C
【解析】解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;一氧化碳的燃烧热为283KJ/mol;故A错误;
B、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;分析图象中一氧化碳和氧气物质的量为1、 ![]() 物质的量不符合反应物质的物质的量;故B错误;
物质的量不符合反应物质的物质的量;故B错误;
C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值;依据热化学方程式判断,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=﹣226kJ/mol;所以反应
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol,故C正确;
D、已知:
①2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
依据盖斯定律②×2+①得到:2Na2O2(s)+2CO(g)=2Na2CO3(s)△H=﹣1018KJ/mol;
即Na2O2(s)+CO(g)=Na2CO3(s)△H=﹣509KJ/mol;
CO(g)与Na2O2(s)反应放出509 kJ热量时,反应的一氧化碳物质的量为1mol,电子转移数为2×6.02×1023 , 故D错误;
故选C.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.


科目:高中化学 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
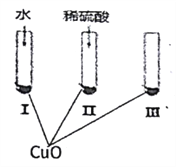
(1)通过实验I可以证明___________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入__________,再加入_________。
(3)探究结果为__________ 。
(4)反应的离子方程式为__________。
【答案】 水不能使氧化铜溶解 可溶性硫酸盐 稀硫酸 H+能溶解氧化铜,而H2O、SO42-两种离子都不能使CuO溶解 CuO+2H+=Cu2++H2O
【解析】(1)实验Ⅰ的试管中的液体成分为水,该实验证明水不溶解CuO;
(2)要想证明起作用的是H+,首先要排除SO42-的干扰,所以在Ⅲ中应该加入可溶性硫酸盐,如Na2SO4(或K2SO4等),最后再加放稀硫酸;
(3)通过对比实验验证起作用的成分,得出结论是:氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用,而H2O、SO42-两种粒子都不能使CuO溶解;
(4)CuO与硫酸电离的氢离子反应生成铜离子和水,反应的离子方程式为:CuO+2H+=Cu2++H2O。
点睛:性质实验方案设计的一般思路、程序是: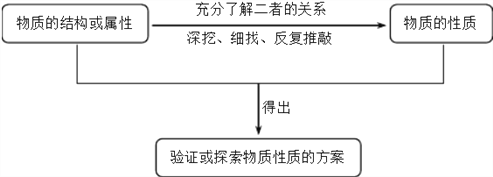 。
。
【题型】实验题
【结束】
28
【题目】(1)己知: 将Cl2通入适量KOH 溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-):c(C1O-)的值与温度高低有关。当n(KOH)=amol时,若某温度下,反应后c(Cl-):c(C1O-)=11,则溶液中c(ClO-):c(ClO3-)=__________。
(2)在P+CuSO4+H2O→CuP+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4 可氧化P的物质的量为_______mol。生成1molCu3P时,参加反应的P 的物质的量为_______mol。
(3)一定量的CuS和Cu2S 的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-) 加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO16.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V的极小值为______L。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol/L 硝酸的溶液100mL,恰好使混合物全部溶解,且放出336mLNO (标准状况下),向所得溶液中加入KSCN 溶液,溶液无红色出现; 若取相同质量的Fe、FeO、Fe3O4的混合物,加入1mol/L 的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福莫特罗是一种治疗哮喘病的药物,它的关键中间体(G)的合成路线如下: 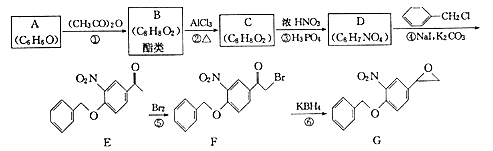
回答下列问题:
(1)F中的含氧官能团有(填名称);反应④的反应类型为 .
(2)反应①的化学方程式为 .
(3)C能与FeCl3溶液发生显色反应,C的结构简式为;D的结构简式为 .
(4)B的同分异构体(不含立体异构)中能同时满足下列条件的共有种. a.能发生银镜反应 b.能与NaOH溶液发生反应 c.含有苯环结构
其中核磁共振氢谱显示为4组峰,且峰面积比为3:2:2:1的是(填结构简式)
(5)参照G的合成路线,设计一种以 ![]() 为起始原料制备
为起始原料制备 ![]() 的合成路线:
的合成路线:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图1是细胞中3种化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示正常细胞,则A、B化合物共有的元素中含量最多的是a
B. 若图1表示细胞完全脱水后化合物含量的扇形图,则A化合物中含量最多的元素为图2中的b
C. 图2的正常细胞中数量最多的元素是c,这与细胞中含量最多的有机物有关
D. 若图1表示正常细胞,则B化合物具有多样性,其必含的元素为C、H、O、N、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制取、储存和利用一直是化学领域研究的热点.H2O热分解可以得到H2和O2 , 高温下水分解体系中主要气体的体积分数与温度的关系如图所示.下列有关说法正确的是( ) 
A.图中A,B表示的粒子依次是O和H
B.图中A,B表示的粒子依次是H+和O2﹣
C.图中A,B重新生成水时的活化能等于0
D.图中A,B重新生成水时的活化能大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.组成元素相同,各元素质量分数也相同的不同物质属于同系物
B.分子式相同的不同物质一定是同分异构体
C.相对分子质量相同的不同物质一定是同分异构体
D.通式相同的不同物质一定属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( ) 
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中B、E为金属单质,D为气体。反应①②是置换反应,反应①②③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
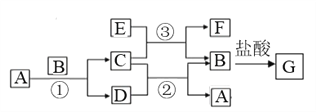
(1)C的俗名_____________,E与足量盐酸反应的离子方程式_________________;
(2)反应③化学方程式_______________________;E加入NaOH溶液中反应的离子反应方程式_______________________;
(3)检验G溶液中金属阳离子的方法________________________;
(4)F与氢氧化钠反应的化学方程式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com