
| 编号 | 0.1mol/L H2C2O4 溶液的体积/mL | 0.01mol/L 酸性 KMnO4 的体积/mL | 蒸馏水的体积/mL | 温度/℃ |
| ① | 2 | 4 | 2 | 25 |
| ② | 3 | |||
| ③ | 50 |
分析 (1)H2C2O4与KMnO4酸性溶液发生氧化还原反应,草酸被氧化生成二氧化碳和水,高锰酸钾被还原为锰离子;
(2)高锰酸钾为紫红色溶液,被草酸还二价锰离子,溶液褪色;根据“观察到紫色褪去”必须满足高锰酸钾的物质的量小于草酸的物质的量解得二者浓度关系;
(3)根据探究温度对反应速率影响时除了温度外其它条件必须相同判断;根据体积浓度对反应速率影响时除了浓度不同,其他条件必须完全相同分析.
解答 解:(1)H2C2O4与KMnO4酸性溶液发生氧化还原反应,草酸被氧化生成二氧化碳和水,高锰酸钾被还原为锰离子,化学方程式:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O;
故答案为:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O;
(2)高锰酸钾为紫红色溶液,被草酸还二价锰离子,溶液褪色,所以若要测定此反应的化学反应速率,最方便的测定方法是测定溶液紫红色褪色时间;
依据方程式:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2(4-3)价,所以每消耗1mol H2C2O4转移2mol电子;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即c(H2C2O4):c(KMnO4)≥$\frac{5}{2}$;
故答案为:溶液紫红色褪色时间;$\frac{5}{2}$;
(3)探究浓度对化学反应速率影响,必须满足除了温度相同,所以满足此条件的实验编号是:②和①;
探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:①和③,应保证各物质的浓度相同,所以②中温度为25度,③中0.1mol/L H2C2O4 溶液的体积/mL为2L,0.01mol/L 酸性 KMnO4 的体积/mL体积为4L;蒸馏水体积为2mL②0.01mol/L 酸性 KMnO4 的体积/mL体积为4L,蒸馏水体积为1mL;
故答案为:②4;1;25;
③2;4;2.
点评 本题考查了探究温度、浓度对反应速率的影响,题目难度中等,注意掌握温度、浓度、压强等对反应速率的影响,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
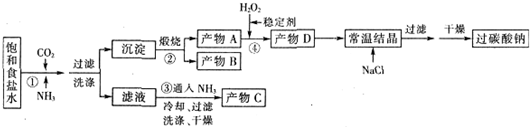
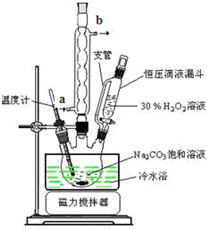
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质的性质 | 实际应用 |
| A | 二氧化锰具有强氧化性 | 用作H2O2分解的氧化剂 |
| B | 液氨汽化时要吸收大量的热 | 用作制冷剂 |
| C | Al2O3熔点高 | 用作耐高温材料 |
| D | 肥皂水显碱性 | 用作蚊虫叮咬处的清洗剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑦ | B. | ①②③⑤⑥⑦ | C. | ①②③④ | D. | ②③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
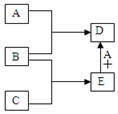 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在江河入海处易形成三角洲 | |
| B. | AgNO3溶液中滴入同浓度NaCl溶液,生成白色沉淀 | |
| C. | 卤水点豆腐 | |
| D. | 同一钢笔同时使用不同牌号的墨水易发生堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
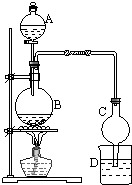 (1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.
(1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
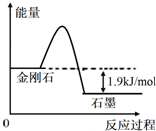 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 总键能/(kJ•mol-1) | 燃烧热/(kJ•mol-1) |
| 金刚石 | a | 395.4 |
| 石墨 | b | 393.5 |
| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知a<b | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+1/2O2(g)═CO(g)△H=-393.5kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com