
| 实验操作 | 预期现象与结论 | 相关离子方程式 |
| 取少量实验Ⅰ中的澄清溶液,加入试剂 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
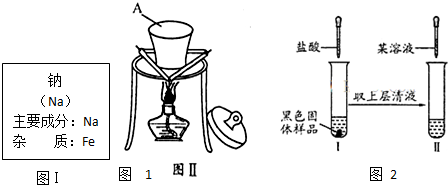
 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④苯⑤Na2C03溶液⑥KCl溶液.( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足而又无其他酸液可加入.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④苯⑤Na2C03溶液⑥KCl溶液.( )| A、①②③ | B、②④⑤ |
| C、①②④⑥ | D、②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中,溶液紫色褪去 | 证明SO2具有漂白性 |
| B | 先加入AgNO3溶液,再加稀硝酸 | 检验Na2SO4溶液中含有Cl- |
| C | 向1mL0.2mol?L-1NaOH溶液中滴入2滴0.1mol?L-1的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol?L-1的FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度 |
| D | 测定Na2SO4溶液与Na2CO3溶液的酸碱性 | 证明非金属性S>C |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
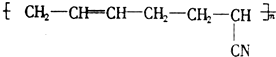 具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
| A、③⑥ | B、②③ | C、①③ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱式滴定管用蒸馏水洗净后没有用标准液润洗 |
| B、锥形瓶用蒸馏水洗净后没用待测液润洗 |
| C、滴定管尖端气泡没有排除,滴定后消失 |
| D、终点读数时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:
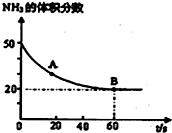 氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝的熔点很高,可用于制作耐高温材料 |
| B、在海轮外壳上镶人锌块,可减缓船体的腐蚀速率 |
| C、电解氯化镁饱和溶液,可制得金属镁 |
| D、明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com