
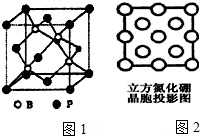
 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.分析 (1)根据等电子体原理,原子数相同,价电子数也相同的粒子互为等电子体,据此书写由第2周期元素组成的与BCl3互为等电子体的阴离子;
(2)①H3N→BH3中N原子的价层电子对数为$\frac{5+3}{2}$=4,据此判断杂化类型;
②根据基态Ti3+的核外电子排布式确定其未成对电子数;根据BH4-中B原子的杂化方式可知其立体构型;根据元素守恒书写化学方程式;
③A.根据B的最外层电子数及形成的共价键数判断;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
C.由CH4变为CO2,碳原子杂化类型由sp3转化为sp;
D.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,、CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构;
(3)①在磷化硼晶体中,磷和硼原子之间通过共价键相互作用,结合性质可知其晶体类型,硼最外层有3个电子,但根据晶胞结构可知,每个硼和磷周围都有4个共价键,所以磷原子含有孤电子对,硼原子含有空轨道,它们之间存在配位键,据此答题;
②根据晶的结构图可知,每个磷原子周围有4个硼原子;
(4)立方氮化硼结构和硬度都与金刚石相似,均为原子晶体,键长越短,键能越大,熔点越高;晶体中B、N原子配位数均为4.
解答 解:(1)根据等电子体原理,原子数相同,价电子数也相同的粒子互为等电子体,所以由第2周期元素组成的与BCl3互为等电子体的阴离子为CO32-或NO3-,
故答案为:CO32-或NO3-;
(2)①H3N→BH3中N原子的价层电子对数为$\frac{5+3}{2}$=4,所以N原子的轨道杂化类型为sp3,
故答案为:sp3;
②基态Ti3+的核外电子排布式为1s22s22p63s23p63d1,其未成对电子数是1.
BH4-中B原子的价层电子对数为$\frac{3+4+1}{2}$=4,所以杂化方式为sp3杂化,则BH4-的立体构型为正四面体,Ti(BH4)3由TiCl3和LiBH4反应制得,反应的化学方程式为TiCl3+3LiBH4═Ti(BH4)3+3LiCl,
故答案为:1;正四面体;TiCl3+3LiBH4=Ti(BH4)3+3LiCl;
③A.B一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故A正确;
B.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,这几种元素都是第二周期元素,它们的族序数分别是:第IIIA族、第IVA族、第VA族、第VIA族,所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故B正确;
C.由CH4变为CO2,碳原子杂化类型由sp3转化为sp,反应前后碳原子的轨道杂化类型已经改变,故C错误;
D.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,、CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故D正确,
故答案为:C;
(3)①在磷化硼晶体中,磷和硼原子之间通过共价键相互作用,结合性质可知其晶体类型为原子晶体,硼最外层有3个电子,但根据晶胞结构可知,每个硼和磷周围都有4个共价键,所以磷原子含有孤电子对,硼原子含有空轨道,它们之间存在配位键,
故答案为:原子;是;
②根据晶的结构图可知,每个磷原子周围有4个硼原子,所以配位数为4,
故答案为:4;
(4)立方氮化硼结构和硬度都与金刚石相似,均为原子晶体,B-N键键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低;晶体中B、N原子配位数均为4,涂“●”和画“×”分别标明B与N的相对位置为: ,
,
故答案为:B-N键键长大于C-C键键长,键能小,所以熔点低; .
.
点评 本题考查物质结构和性质,涉及电离能、电负性、杂化方式的判断、空间构型的判断等知识点,根据价层电子对互斥理论、构造原理等知识来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物都能与醋酸发生酯化反应 | |
| B. | 除饱和烃之外的其他烃都能发生聚合反应 | |
| C. | 醇类、卤代烃都能发生消去反应 | |
| D. | 氨基酸、乙酸和苯酚都能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-) | B. | n(NH4+) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | n(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl水解呈酸性,不能用来当做肥料使用 | |
| B. | 氧化镁的熔点高,可用于制作耐高温的材料 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
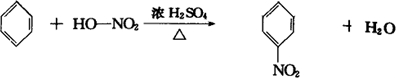

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com