
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮氧化物(含NO、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2 +H2O。则生成的盐溶液中NaNO3的物质的量为
+H2O。则生成的盐溶液中NaNO3的物质的量为
A. 0.2 mol B. 0.4 mol C. 0.6 mol D. 0.8 mol
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
常温下;下列各组离子在指定溶液中一定能大量共存的是( )。
A.0.1 mol·L-1 NaOH溶液:K+、Na+、S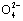 、C
、C
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、N 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、N 、I-、SCN-
、I-、SCN-
D.c(H+) /c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、N
/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、N
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.元素的原子得失电子后,一定形成8电子的稳定结构
D.有单质参加或生成的反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 :
(2)过程I 加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S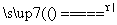 6Cu+SO2↑,对于该反应,下列说法正确的是 ( )
6Cu+SO2↑,对于该反应,下列说法正确的是 ( )
A.该反应的氧化剂只有Cu2O
B.Cu既是氧化产物,又是还原产物
C.Cu2S在反应中既是氧化剂又是还原剂
D.还原产物与氧化产物的物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
某醇在适当条件下与足量的乙酸发生酯化反应,得
到的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,有关该醇应该具有的结构特点的描述
正确的是
A.该醇分子中一定具有甲基 B.该醇分子中一定没有甲基
C.该醇分子中至少含有三个碳原子 D.该醇分子中具有两个醇羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C4H10O的醇能被氧化,但氧化产物不是醛,则该醇的结构简式是 ( )
A.C(CH3)3OH B.CH3CH2CH(OH)CH3
C.CH3CH2CH2CH2OH D.CH3CH(CH3)CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定有大量的CO32-
C.用洁净的铂丝蘸取该溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色。该溶液中一定含有钾离子,可能含有钠离子。
D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com