
【题目】取0.1molL﹣1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2OHA+NaHCO3、2NaB+CO2+H2O2HB+ Na2CO3,则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
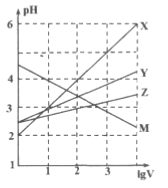
A. X是HA、Z是HB
B. Y是HA、Z是HB
C. Z是HA、R是HB
D. Z是HA、Y是HB
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4==="2" KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
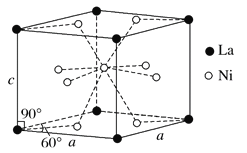
①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(1)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为_____mL,如果实验室有10 mL、25mL、50 mL 量筒,应最好选用_____mL量筒。
(2)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是_____ ,_____。
(3)请说出本实验中玻璃棒的作用:_______ , _______。
(4)下面操作造成所配稀硫酸溶液浓度偏高的是________(填序号)。
A.浓硫酸稀释后溶液没有冷却到室温就转移
B.容量瓶中原有少量蒸馏水
C.向容量瓶加水定容时眼睛俯视液面
D.定容时加水超过刻度线,立即用滴管吸出多余液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3 g纯净的金属钠在干燥的空气中,被氧化后得到3.5 g固体,由此可判断出产物是
A. 氧化钠 B. 过氧化钠
C. 氧化钠和过氧化钠的混合物 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 用惰性电极电解熔融氯化钠: 2Cl-+2H2O= Cl2↑+H2↑+2OH-
B. 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O+H2O
C. Fe(NO3)3溶液中加入过量的HI溶液: 2Fe3++ 2I-= 2Fe 2++I2
D. NaNO2溶液中加入酸性KMnO4溶液: 2MnO4-+5NO2--+6H+=2Mn2++5NO3-+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜用于医药、农药、染料工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)2SOCl2(g).
(1)在373K时,向2L的密闭容器中通入SO2、SCl2与Cl2均为0.04mol,发生上述反应.测得其压强(p)随时间(t)的变化为表中数据I(反应达到平衡时的温度与起始温度相同).
t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
请回答下列问题:
①反应开始至达到平衡时,v(SOCl2)=____________。
②若只改变某一条件,其他条件相同时,测得其压强随时间的变化为表中数据II,则改变的条件是_____。
(2)如图是某同学测定上述反应平衡常数的对数值(lgK)与温度的变化关系点.
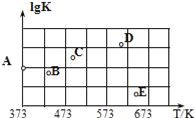
A点的数值为_____。(已知:lg4=0.6)
(3)已知反应S4(g)+4Cl2(g)═4SCl2(g) 的△H=﹣4kJmol﹣1,1molS4(g)、1molSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为_____kJ。
(4)某种锂电池的负极由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2═4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.此电池工作时正极的电极反应式为________________,电解质中锂离子定向移向_____极(填“正极”或“负极”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是同分异构体,其鉴別可采用化学方法或物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用质谱法B.利用红外光谱法
C.利用金属钠或者金属钾D.利用核磁共振氢谱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com