
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图:下列说法不正确的是( ) 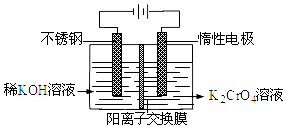
A.在阴极式,发生的电极反应为:2H2O+2e﹣═2OH﹣+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42﹣+2H+Cr2O72﹣+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O ![]() 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.铬原子的价电子排布式为3d44S2
【答案】D
【解析】解:A.电极均为惰性电极,在阴极室发生还原反应,水得电子变成氢气,电极方程式为2H2O+2e﹣═2OH﹣+H2↑,故A正确;
B.电解时,阳极发生氧化反应,水失去电子放电,电极反应为:2H2O﹣4e﹣=4H++O2↑,阳极区酸性逐渐增强,则平衡2CrO42﹣+2H+Cr2O72﹣+H2O向右移动,溶液逐渐由黄色变为橙色,故B正确;
C.阴极电极反应为:4H2O+4e﹣=4OH﹣+2H2↑,阳极反应为:2H2O﹣4e﹣=4H++O2↑,4CrO42﹣+4H+═2Cr2O72﹣+2H2O,总电解方程式为4K2CrO4+4H2O ![]() 2K2Cr2O7+4KOH+2H2↑+O2↑,故C正确;
2K2Cr2O7+4KOH+2H2↑+O2↑,故C正确;
D.铬原子的价电子排布式为3d54S1,故D错误.
故选D.


科目:高中化学 来源: 题型:
【题目】某学生用0.1000molL﹣1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 .
(2)滴定: I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ,用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号) , 该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应:判断滴定终点的现象是 .
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果(填“偏大”、“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=;
②烧碱样品的纯度为%.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaCl中含有的Ca2+、Mg2+、SO42﹣、HCO3-等离子,通常采用以下四种试剂:①Na2CO3②BaCl2 ③NaOH ④HCl,加入试剂合理的操作顺序是( )
A.①②③④
B.③①②④
C.④②①③
D.③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电解质的说法正确的是( )
A.纯水的导电性很差,所以水不是电解质
B.SO3水溶液的导电性很好,所以SO3是电解质
C.液态的铜导电性很好,所以铜是电解质
D.Na2O液态时能导电,所以Na2O是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别稀硫酸和浓硫酸既简单又安全的方法是
A.各取少量于试管中加入几片铜片
B.用玻璃棒各蘸少许点在滤纸上
C.各取少量于试管中滴加NaOH溶液
D.各取少量于试管中滴加BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4种金属分别加入到4支装有稀盐酸的试管中,记录的现象如下表所示,正确的是
选项 | 加入的金属 | 是否有气体产生 |
A | 铜 | 有 |
B | 铁 | 有 |
C | 铝 | 无 |
D | 镁 | 无 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存、且溶液为无色透明的离子组是 ( )
A.NH4+、Al3+、SO42-、NO3-B.K+、Na+、SO42-、Ba2+
C.K+、Na+、MnO4-、Cl-D.Ca2+、K+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒—空气电池工作时反应为:4VB2+11O2===4B2O3+2V2O5,室温下用该电池为电源,用惰性电极电解饱和氯化钠溶液,装置如图。当外电路中通过0.04 mol电子时,乙装置中溶液的体积为400 mL。则下列说法正确的是
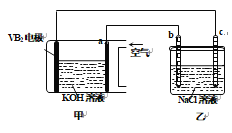
A. 外电路中电子由a电极流向b电极
B. c电极上生成气体的体积为4.48 L
C. 乙装置中溶液的pH为13
D. VB2电极发生的电极反应为:2VB2+11H2O―22e-===V2O5+2B2O3+22H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,H2SO4作为电解质。下列关于该燃料电池的叙述正确的是 ( )
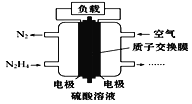
A. 电流从左侧电极经过负载后流向右侧电极
B. 该燃料电池正极发生的电极反应式为N2H4-4e-N2↑+4H+
C. 利用该燃料电池工业上可以电解熔融MgCl2 制备Mg
D. 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com