
下列关于电离平衡常数(K)的说法正确的是
A.电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数相互关系为:K1<K2<K3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.前四周期中,原子最外层为1个电子的元素有5种
B.Fe2+的价电子排布为3d6
C.2p轨道上有1个未成对电子的原子与3p轨道上有1个未成对电子的原子化学性质相似
D.AB3型分子的中心原子A采取sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列问题
(1)羟基的电子式 ,二氧化碳的电子式 ,乙酸中官能团的名称 丁烷同分异构体的结构简式
(2)苯和浓HNO3反应的化学方程式 ,反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g)  C(g)+D(g),5 min后达到平衡,已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5 min后达到平衡,已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
A.a=3 B.a=2
C.B的转化率为40% D.B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上在合成塔中采用下列反应合成甲醇。
CO(g)+2H2(g)  CH3OH(g) ΔH=Q kJ·mol-1
CH3OH(g) ΔH=Q kJ·mol-1
(1)下表所列数据是该可逆反应在不同温度下的化学平衡常数(K)
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断Q________0(填“>”、“<”或“=”),该反应在________(填“较高”或“较低”)温度下有利于自发进行。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2 mol·L-1,此时对应的温度为____________;CO的转化率为____________。
H2充入2 L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2 mol·L-1,此时对应的温度为____________;CO的转化率为____________。
(2)请在图中画出压强不同,平衡时甲醇的体积分数(φ)随温度(T)变化的两条曲线(在曲线上标出p1、p2,且p1<p2)。
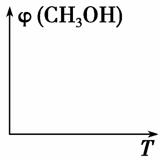
(3)要提高CO的转化率且提高反应速率,可以采取的措施是________(填字母序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.通入H2加压 e.通入惰性气体加压 f.分离出甲醇
(4)已知一定 条件下,CO与H2在催化剂的作用下生成5 mol CH3OH时,能
条件下,CO与H2在催化剂的作用下生成5 mol CH3OH时,能 量的变化为454 kJ。在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加入反应物,测得反应达到平衡时的有关数据如下:
量的变化为454 kJ。在该条件下,向容积相同的3个密闭容器中,按照甲、乙、丙三种不同的投料方式加入反应物,测得反应达到平衡时的有关数据如下:
| 平衡时数据 | 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1 mol CO 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| CH3OH的浓度(mol·L-1) | c1 | c2 | c3 | |
| 反应吸收或放出的能量(kJ) | a | b | c | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 |
下列说法正确的是________(填字母序号)。
A.2c1>c3 B.a+b<90.8
C.2p2<p3 D.α1+α3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能证明HNO2是弱电解质的是
①滴入酚酞,NaNO2溶液显红色 ②用HNO2溶液做导电实验,灯泡很暗 ③等pH、等体积的盐酸和HNO2溶液中和碱时,HNO2的中和碱能力强 ④0.1 mol·L-1HNO2溶液的pH=2 ⑤HNO2与CaCO3反应放出CO2气体 ⑥c(H+)=0.1 mol·L-1的HNO2溶液稀释至1 000倍,pH<4
A.①⑤ B.②⑤
C.③⑥ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.为提醒人们在使用浓硫酸时要注意安全,贮存浓硫酸的容器上贴有如图标识
B.实验室可通过蒸馏的方法除去自来水中含有的Cl-等杂质制蒸馏水
C.做焰色反应实验时,应先将铂丝(或铁丝)用稀硫酸洗净,在酒精灯外焰上灼烧至没有颜色时,再蘸取待检溶液进行实验
D.由于碱金属单质化学性质活泼,实验室中的各种碱金属单质均保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO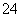 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性
B.水电离出来的c(H+)=1×10-10 mol·L-1
C.c(H+)=c(OH-)+c(SO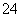 )
)
D.该温度高于25 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com