
(10分)右面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图: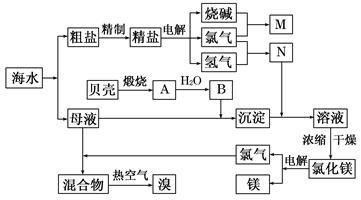
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液。则加入试剂的顺序是(填编号) 。
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,叙述错误的是 。
A.精制饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式: 。
(4)利用MgCl2· 6H2O可制得无水氯化镁,应采取的措施是 。
(5)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
。
(1)BDCA 或 CBDA 或BCDA等 (2)D
(3)2Cl—+2H2O==Cl2↑+H2↑+2OH—
(4)在HCl气流中加热脱水(防止MgCl2水解)
(5)H2O+Na2SO3+Br2==Na2SO4+2HBr或H2O+Na2SO3+Br2="=2NaBr" +H 2SO4
解析试题分析:(1)、氯化钡溶液用于除去SO42-,碳酸钠溶液用于除去Ca2+、Mg2+,氢氧化钠溶液用于进一步除去Mg2+,盐酸用于除去上一步残留的氢氧化钠。
(2)、精制的饱和食盐水进入阳极室;纯水(加入一定量的NaOH溶液)加入阴极室,通电后H2O在阴极表面放电生成H2,Na+则穿过离子膜由阳极室进入阴极室,此时阴极室导入的阴极液中含有NaOH;Cl-则在阳极表面放电生成Cl2。电解后的淡盐水则从阳极室导出,经添加食盐增加浓度后可循环利用 ;电解槽的阳极材料若为Fe则会发生氧化反应,干扰主反应,应为石墨电极(惰性电极)
(3)、电解饱和食盐水原理应为:2NaCl+2H2O==Cl2↑+H2↑+2NaOH,改写成离子方程式为:2Cl—+2H2O==Cl2↑+H2↑+2OH—
(4)、加热时MgCl2会发生水解,故应在HCl气流中加热脱水
(5)、Na2SO3被氧化为Na2SO4,Br2被还原为Br- ,H2O+Na2SO3+Br2==Na2SO4+2HBr
考点:电解饱和食盐水
点评:本题属于常规型的工艺流程题目,涉及到的化学反应都比较简单,难点在于将化学原理与生产装置联系起来,分析装置的目的以及可行性。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014届重庆市高二12月月考化学试卷(解析版) 题型:填空题
(10分)右面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:
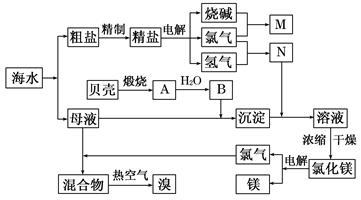
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
A.盐酸 B.氯化钡溶液 C.氢氧化钠溶液 D.碳酸钠溶液。则加入试剂的顺序是(填编号) 。
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,叙述错误的是 。
A.精制饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式: 。
(4)利用MgCl2· 6H2O可制得无水氯化镁,应采取的措施是 。
(5)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com