
【题目】将4molA气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气),若经2s(秒)后测得C的浓度为0.6mol·L-1 ,现有下列几种说法,其中正确的是( )
2C(气),若经2s(秒)后测得C的浓度为0.6mol·L-1 ,现有下列几种说法,其中正确的是( )
A.用物质A表示的反应的平均速率为3mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6mol·L-1·s-1
C.2s时物质A的转化率为70%
D.2s时物质B的浓度为0.7mol·L-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂。一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)![]() 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时段产生O2的量见表格:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时段产生O2的量见表格:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
上述反应过程中能量转化形式为光能转化为____能,达平衡过程中至少需要吸收光能___kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2 molNH3,放出92.2kJ热量。已知:

则1 molN—H键断裂吸收的能量约等于_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应 2NO2(g) ![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数
D. CO2+H2![]() CO+H2O 的平衡常数表达式为 K =c(CO)/[c(CO2)c(H2)]
CO+H2O 的平衡常数表达式为 K =c(CO)/[c(CO2)c(H2)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液中CH3COOH+NH3= CH3COONH4
B.氢氧化钠与氯化铵溶液混合加热:![]() +OH-= NH3·H2O
+OH-= NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+=![]() +H2O
+H2O
D.硫酸铵与氢氧化钡溶液:![]() +OH-= NH3·H2O
+OH-= NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作所得出的现象和结论均正确的是( )
实验操作 | 实现现象 | 结论 | |
A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 该溶液中有 |
B | 将石蜡油气化后,使气体流经碎瓷片,将生成的气体通入酸性高锰酸钾溶液 | 溶液紫红色褪去 | 碎瓷片的主要作用是使石蜡油受热均匀 |
C | 向 | 有砖红色沉淀生成 | Ksp: |
D | 将变黑的银器放入装满食盐水的铝盆中,二者直接接触 | 银器恢复往日光泽 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是无色透明的晶体,易溶于水,其水溶液显碱性。在漂白工业中用作“脱氯剂”,常用黄铁矿(主要成分是![]() )经以下流程来制备硫代硫酸钠
)经以下流程来制备硫代硫酸钠
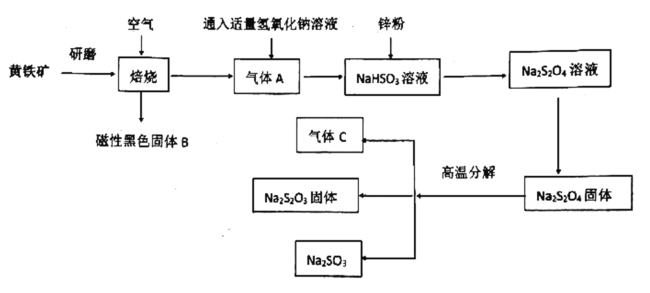
已知:气体C可以使品红溶液褪色
(1)研磨的目的是:____________,磁性黑色固体B的化学式为:________。
(2)尾气C能否用氢氧化钙溶液吸收:________(填“能”或“不能”),原因是:
________________。
(3)写出![]() 固体高温分解反应方程式:__________________________。
固体高温分解反应方程式:__________________________。
(4)![]() 溶液与盐酸不能稳定存在,用离子方程式解释不能存在的原因:
溶液与盐酸不能稳定存在,用离子方程式解释不能存在的原因:
____________________。
(5)请用“<”符号表示出亚硫酸氢钠溶液中的各离子浓度大小关系:____________。
(6)硫代硫酸钠在漂白工业中用作“脱氯剂”,标准状况下当消耗31.6g硫代硫酸钠时吸收氯气的积为:________L。
(7)已知![]() 溶液中
溶液中![]() ,求
,求![]() 的比值________(已知:
的比值________(已知:![]() 溶液的一级电离常数为
溶液的一级电离常数为![]() ,二级电离常数为
,二级电离常数为![]() ,水的电离常数为
,水的电离常数为![]() ,请用含有
,请用含有![]() 、
、![]() 、
、![]() 、b的式子表示)。
、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
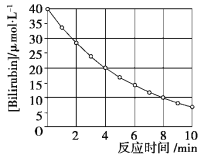
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入100g原粮,E中加入20.00mL 1.50×l0-3mol/L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)仪器D的名称是________________________。
(2)AlP与水反应的化学方程式为__________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸( )的碱性溶液,其作用是_____________________________。
)的碱性溶液,其作用是_____________________________。
(4)通入空气的作用是____________________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为______________。(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-4mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为______________, 则该原粮中磷化物(以PH3计)的含量为_____ mg·kg-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com