
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 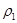 |  | |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
 d.混合气体的密度保持不变
d.混合气体的密度保持不变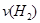 =
=  b.氮气的转化率:
b.氮气的转化率: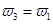 c.
c. 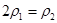 d.
d.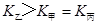
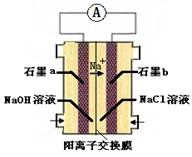
 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。 (14分,每空2分)(1)be(全对2分,对1个得1分,有错不得分)
(2)0.25mol/(L·min)(单位不写或错写扣1分)
(3)K=4(1-C1)2/C1·(3C1-1.5)3
(4)C
(5)2N2(g)+6H2O(l)="4" NH3(g)+3 O2(g)△H=+1530kJ·mol-1
(6)阴 N2+6H+++6e-==2 NH3
解析试题分析:(1)合成氨反应是反应前后气体物质的量发生变化的可逆反应,所以压强不变时证明已达平衡状态,b正确;容器内的各物质的浓度比符合化学计量数之比时未必是平衡状态,a错误;根据好好的定义,正逆反应速率相等时达平衡状态,氢气的反应速率是氮气反应速率的3倍,c错误;容器的体积不变,所以气体的密度始终不变,d错误;气体的质量不变,而气体的总物质的量变化,当平均相对分子质量不变时已达平衡状态,e正确,答案选be;
(2)根据氮气的体积密度即浓度可计算平衡时氮气的物质的量为3mol,则消耗氮气的物质的量是1mol,氢气的物质的量是3mol,所以用氢气表示的反应速率为3mol/2L/6min="0.25" mol/(L·min);
(3)氮气、氢气的起始浓度分别为1mol/L、1.5mol/L,根据氮气平衡时的浓度可计算消耗氮气的浓度为1- C1,消耗氢气的浓度是3(1- C1),生成氨气的浓度为2(1- C1),根据化学平衡常数的表达式可得K甲=c(NH3)2/c(N2)c(H2)3=4(1-C1)2/C1·(3C1-1.5)3
(4)A、乙容器的反应物浓度是甲容器的2倍,保持恒温、恒容,乙容器相当于在2个甲的基础上又正向移动,氮气的浓度减小,所以2 C1>1.5mol/L,错误;B、把丙的2mol氨气转化为3mol氢气和1mol氮气与丙达到的平衡是等效的。甲与丙相比,甲的氢气浓度大,氮气的转化率高,错误;C、乙容器的气体质量是甲容器的气体质量的2倍,容器的体积都为2L,所以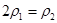 ,正确;D、三个容器的温度相同,则化学平衡常数相等,错误,答案选C;
,正确;D、三个容器的温度相同,则化学平衡常数相等,错误,答案选C;
(5)根据盖斯定律N2(g)+3H2(g)=2NH3(g)△H=-93.0kJ?mol-1,①
2 H2(g)+O2(g)="2" H2O(l) △H="-572" kJ?mol-1 ②
则2N2(g)+6H2O(l)="4" NH3(g)+3 O2(g)的△H=①×2-②×3="+1530" kJ?mol-,所以所求热化学方程式为
2N2(g)+6H2O(l)="4" NH3(g)+3 O2(g)△H=+1530kJ·mol-1
(6)氮气中的N元素化合价为0,氨气中的N元素的化合价为-3,所以氮气发生还原反应,则氮气是电解池的阴极;发生的电极反应式为N2+6H+++6e-==2 NH3
考点:考查化学平衡状态的判断,化学平衡常数的计算,盖斯定律的应用,电化学原理的应用,反应速率的计算


科目:高中化学 来源: 题型:填空题
(7分)某同学模拟工业“折点加氯法”处理氨氮废水的原理,进行如下研究。
| 装置(气密性良好,试剂已添加) | 操作 | 现象 |
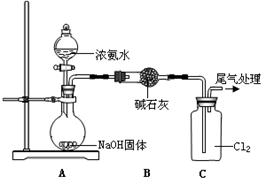 | 打开分液漏斗活塞,逐滴加入浓氨水 | ⅰ.C中气体颜色变浅 ⅱ.稍后,C中出现白烟并逐渐增多 |
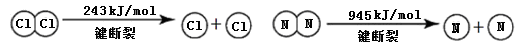
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知1molCaCO3分解需要吸收178kJ 热量,1mol焦炭完全燃烧放出393.5kJ ,试回答下列问题
(1)写出碳酸钙分解的热化学反应方程式
(2)试计算如果0.5t CaCO3煅烧成CaO(s),在理论上要用焦炭多少千克。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分) 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。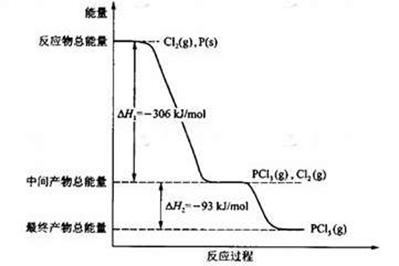
根据上图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率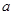 1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为 2,
2,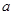 2
2 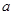 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3= ,P和Cl2一步反应生成1 mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。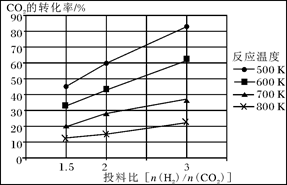
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-570 kJ·mol-1
②CH4(g)+4NO(g)="=2" N2(g) +CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
则CH4 (g)+2NO2(g)="=" N2(g)+CO2(g)+2H2O(g) ΔH=___________。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见下图: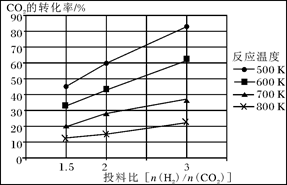
①此反应为 (填“放热”、“吸热”);若温度不变,提高投料比[n(H2)/n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池正极的电极反应式_______________________。
③在a MPa和一定温度下,将6 mol H2和2 mol CO2在2 L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即1/6),此时CO2的转化率是多少?(计算结果保留2位有效数字)
④在a MPa和500K下,将10mol H2和5 mol CO2在2 L密闭容器中混合,5min达到平衡,请在答题卡的坐标图中画出H2浓度变化图。(请标出相应的数据)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示: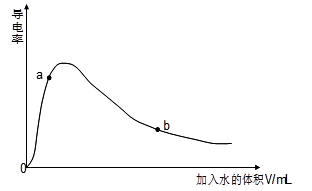
①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1="-57.3" kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
H+(aq) +CH3COO-(aq) △H2="+1.3" kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
C6 H5- CH2 CH3 (g) C6 H5- CH=CH2 (g) +H2(g) ΔH1
C6 H5- CH=CH2 (g) +H2(g) ΔH1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示: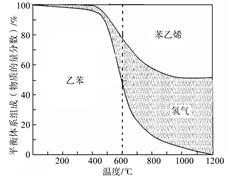
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
① 氢气的物质的量分数为 ;乙苯的物质的量分数为 ;
② 乙苯的平衡转化率为 ;
③ 计算此温度下该反应的平衡常数(请写出计算过程)。
(2) 分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(4)已知:
3C2 H2 (g)  C6 H6 (g) ΔH2
C6 H6 (g) ΔH2
C6 H6 (g) + C2H4 (g)  C6 H5- CH2CH3 (g) ΔH3
C6 H5- CH2CH3 (g) ΔH3
则反应3C2H2 (g)+ C2H4 (g)  C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) = CO2(g)
途径II:先制水煤气: C(s) + H2O(g) =" CO(g)" + H2(g)
燃烧水煤气:2 CO(g) + O2(g) = 2CO2(g);
2H2(g)+O2(g) =2H2O(g)
已知:①C(s)+O2(g)=CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ 1/2O2 (g) =CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)CO(g) + H2O(g) = H2(g) + CO2(g) 是 (填“放热反应”或“吸热反应”)
(2)根据盖斯定律,煤和气态水生成水煤气的反应热△H= 。
(3)根据两种途径,下列说法错误的是( )
| A.途径II制水煤气时增加能耗,故途径II的做法不可取 |
| B.与途径I相比,途径II可以减少对环境的污染 |
| C.与途径I相比,途径II可以提高煤的燃烧效率 |
| D.将煤转化为水煤气后,便于通过管道进行运输 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com