
下列离子方程式书写正确的是
A.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑
B.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
C.漂白粉溶液中通入少量SO2气体:Ca2+ +2ClO- +SO2 +H2O =CaSO3↓+2HClO
D.Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
B
【解析】
试题分析:A、将氯化亚铁溶液和稀硝酸混合应为:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑,错误;B、向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O,正确;C、漂白粉溶液中通入少量SO2气体应为:Ca2+ +ClO- +SO2 +H2O =CaSO4↓+2H++Cl-,错误;D、Fe(OH)3与足量的HI溶液反应应为: 2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,错误。
考点:考查离子方程式正误判断。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
如下图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是
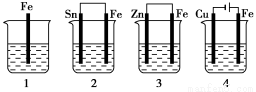
A.4>2>1>3 B.2>1>3>4
C.4>2>3>1 D.3>2>4>1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:填空题
选考[化学—选修5 有机化学技术] (15分)
2013年1月13日中国应用技术网报道了利用苯制备偶氮染料和医药中间体的方法,下面是制备偶氮染料F和医药中间体Y的流程图如下:
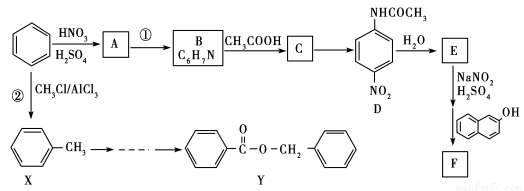
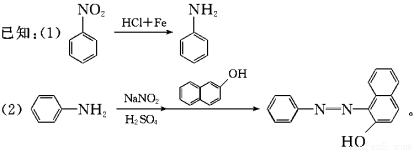
回答下列问题:
(1)苯的核磁共振氢谱中有________峰,反应①的反应类型____________;
(2)写出D→E反应的化学方程式______________________。
(3)写出化合物A、F的结构简式: A____________、F____________。
(4)设计A→D的目的是______________________。
(5)写出满足下列条件的C的任意两种同分异构体的结构简式________。
a.是苯的对位二取代产物; b.能发生银镜反应
(6)参照上述流程图设计从X到Y的合成路线。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按下图所示方法分离和提取金属单质:
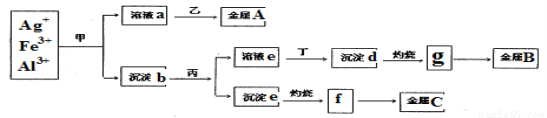
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备。对该实验分析正确的是
A.甲是氢氧化钠,丁为稀硫酸
B.沉淀b为混合物,主要成分为沉淀d和沉淀e
C.g、f都为氧化物,工业上均采用电解g与f获得对应金属单质
D.金属A、B、C分别为Ag、 Fe、Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列实验不能达到预期目的的是
序号 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | 用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 | 比较盐酸、醋酸的相对强弱 |
C | 测定Na2CO3、Na2SO4两溶液的pH | 比较碳、硫的非金属性强弱 |
D | MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
B.氢氧化钠固体保存在带橡胶塞的广口瓶中
C.二氧化硅不与任何酸反应,可用石英制造耐酸容器
D.少量金属钠保存在煤油、四氯化碳等有机溶剂中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:填空题
(16分)X、Y、Z、E、M、Q、R为七种短周期的主族元素,它们的原子序数依次增大,其中X+无电子,Y、Z同一周期且相邻,X与E、Z与Q分别为同一主族,M的原子序数是Y的2倍,Q的质子数比E多5。J为ds区原子序数最小的元素。请用推断出的元素回答下列问题:
(1)Y、Z、Q三元素的第一电离能由大到小的顺序为__________,Y2 、X2分子中共价键的数目之比为_________,MR4分子的中心原子的杂化轨道类型是_______。
(2)由Q、R两元素可按原子个数比l:l组成化合物T,化合物T中各原子均满足8电子的稳定结构,则T的电子式为________。固体化合物E2Z2投人到化合物E2Q的水溶液中,只观察到有沉淀产生,该反应的离子方程式为______________________。
(3)J元素基态原子的外围电子排布式为___________。向JQZ4溶液中逐滴加人Y元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解得到深蓝色的透明溶液,该沉淀溶解的离子方程式是_____________。
(4)J2Z为半导体材料,在其立方晶胞内部有4个Z原子,其余Z原子位于面心和顶点,则该晶胞中有______个J原子。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:填空题
(12分)已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
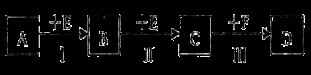
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于____________(填“离子化合物”或“共价化合物”)。
②反应I的化学方程式为____________________________________________。
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为________________mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34 g/mol,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为____________(填化学式)。
②将少景Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式__________。在该反应中若有74.5 g NaClO被还原,则转移电子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
利用图中所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com