
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液480mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液480mL.根据这两种溶液的配制情况回答下列问题:| n |
| V |
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| 操作步骤 | |
| 反应现象 | |
| 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
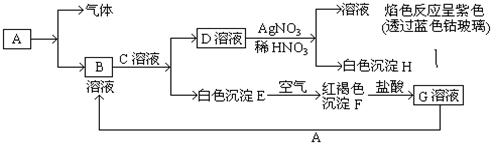
查看答案和解析>>
科目:高中化学 来源: 题型:
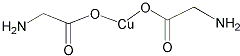
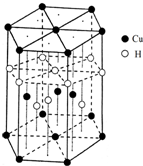
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、气体单质中(除稀有气体),一定有σ键,可能有π键 |
| C、杂化前后的轨道数不变,但轨道的形状发生了改变 |
| D、sp3、sp2、sp杂化轨道的夹角分别一定为109°28′、120°、180° |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cl-的结构示意图: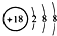 | ||
| B、光导纤维主要成分的化学式:Si | ||
| C、1H2、2H2、3H2互为同位素 | ||
D、质子数为53,中子数为78的碘原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HX>HY>HZ |
| B、HY>HX>HZ |
| C、HZ>HY>HX |
| D、HZ>HX>HY |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com