
 ③白磷 ④氯气
③白磷 ④氯气 ⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷
⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧红磷 ,含四原子核10电子的阳离子离子符号H3O+,含四原子核18电子的共价化合物化学式H2O2.
,含四原子核10电子的阳离子离子符号H3O+,含四原子核18电子的共价化合物化学式H2O2. 分析 (1)系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
具有相同分子式而结构不同的化合物互为同分异构体;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物;
(3)氨气是四核10电子的共价化合物,氨气分子中每个氢原子和氮原子形成一个共用电子对.
解答 解:(1)②和⑤分子式相同结构不同,互为同分异构体;
③和⑧是由磷元素组成的不同单质,互为同素异形体;
故答案为:②和⑤、③和⑧;
(2)在①CaCl2、②KOH、③He、④H2SO4、⑤Na2O2、⑥I2中,不含离子键的③、④、⑥,既含有离子键又含有共价键的②⑤,故答案为:③、④、⑥;②⑤;
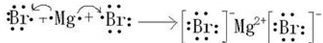
(3)氨气是四核10电子的共价化合物,氨气分子中每个氢原子和氮原子形成一个共用电子对,氨气的电子式为 ;含四原子核10电子的阳离子离子符号为:H3O+;含四原子核18电子的共价化合物化学式H2O2 (PH3、NH2F等),故答案为:
;含四原子核10电子的阳离子离子符号为:H3O+;含四原子核18电子的共价化合物化学式H2O2 (PH3、NH2F等),故答案为: ;H3O+;H2O2 (PH3、NH2F等).
;H3O+;H2O2 (PH3、NH2F等).
点评 本题主要考查了电子式的书写、化学键的判断,难度不大,注意电子式的书写方法,注意离子和原子、分子电子式的不同.


科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | ||||
| ③ | 298 | 10 | 6.0 | 0.30 | |
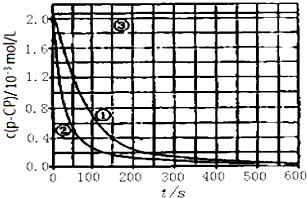
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 键能 | 键能 | 键能 | |||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 |
| S=S | 255 | H-S | 339 | C-F | 427 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
| C-O | 347 | H-O | 464 |
| A. | 键能越大,物质的热稳定性越强 | |
| B. | 热化学方程式H2(g)+Cl2(g)═2HCl(g);△H=-QkJ•mol-1中,Q的值为185 | |
| C. | H-O键的键能大于H-S键的键能,所以H2O的溶沸点高于H2S的溶沸点 | |
| D. | C-Br键的键能应在218kJ•mol-1-330kJ•mol-1之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.05mol Na2O2固体中含有的阴离子数为0.05NA | |
| B. | 标准状况下,2.24L CH4所含的原子数为0.5NA | |
| C. | 1molSO2与足量O2在一定条件下反应,共转移2NA个电子 | |
| D. | 1L0.1mol•L-1氨水中含有的NH3•H2O分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(g)△H=-48.40kJ•mol-1 | |
| B. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-5517.6kJ•mol-1 | |
| C. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=+5517.6kJ•mol-1 | |
| D. | C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1)△H=-48.40kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | 实验结论 | |
| A | 向蛋白质溶液中加入饱和硫酸铵溶液 | 有白色沉淀析出,再加水,沉淀溶解 | 硫酸铵使蛋白质变性 |
| B | 将乙醇与酸性重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 蔗糖溶液中加入稀硫酸,水解后加入银氨溶液,水浴加热 | 未出现银镜 | 蔗糖的水解产物为非还原性糖 |
| D | 将新制Cu(OH)2与葡萄糖溶液混合加热 | 产生砖红色沉淀(Cu2O) | 葡萄糖具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
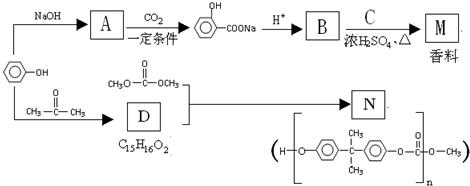
 +NaOH→
+NaOH→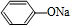 +H2O.
+H2O. ;
;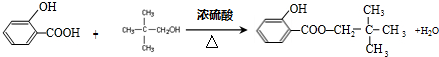 .
.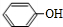 +
+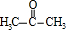 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$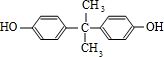 +H2O由D生成N的反应类型是缩聚反应
+H2O由D生成N的反应类型是缩聚反应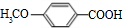 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com