
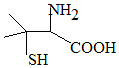
 靑霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物X.己知X的结构如图,下列有关X的说法正确的是( )
靑霉素是最重要的抗生素,其在体内经酸性水解后得到一种有机物X.己知X的结构如图,下列有关X的说法正确的是( )| A. | X为烃的含氧衍生物 | |
| B. | X的分子式为C5H10NO2S | |
| C. | X只能发生取代反应 | |
| D. | X中碳原子上的H若有1个被Cl取代,有2种不同产物 |
分析 由结构可知分子式,分子中含氨基、-COOH、-SH,C原子上只有2种H,结合羧酸等有机物的性质来解答.
解答 解:A.烃的含氧衍生物含C、H、O元素,该有机物还含N、S元素,则不是烃的含氧衍生物,故A错误;
B.由结构可知分子式为C5H11NO2S,故B错误;
C.含-COOH可发生取代反应、中和反应,含氨基、-COOH可发生缩聚反应,故C错误;
D.C原子上只有2种H,碳原子上的H若有1个被Cl取代,有2种不同产物,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意判断C原子上的H,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证Cl2的氧化性强于I2 | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,可观察到溶液变成蓝色 |
| B | 配制100mL 1.0mol•L-1CuSO4溶液 | 将25gCuSO4•5H2O溶于100mL蒸馏水中 |
| C | 比较水与乙醇中氢的活泼性 | 分別将少量钠投入到盛有水和乙醇的烧杯中 |
| D | 验证Cu(OH)2的溶解度小于Mg(OH)2 | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液,可观察到先有白色沉淀生成,后变为浅蓝色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5种离子 | |
| B. | C1-一定存在,且c Cl-)≥0.4mol/L | |
| C. | SO42-、NH4+一定存在,CO32-可能存在 | |
| D. | CO32-、Al3+一定不存在,K+一定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
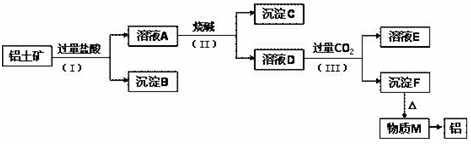
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③①④⑤ | B. | ①②③⑤④ | C. | ③②①⑤④ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
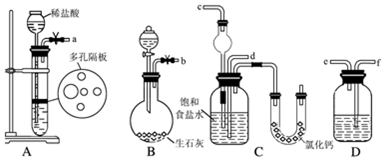
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
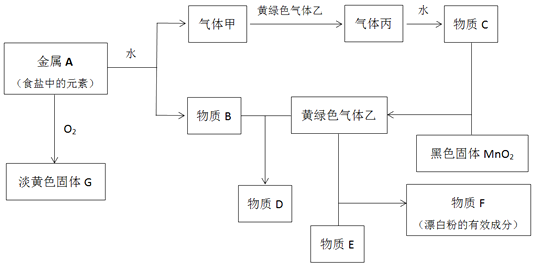
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②④ | B. | 只有③④ | C. | 只有②③④ | D. | 均有 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com