
| A. | 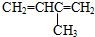 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. |  2-羟基丁烷 2-羟基丁烷 | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. |  邻羟基苯甲酸 邻羟基苯甲酸 |
分析 A、烯烃命名时,选含官能团的最长的碳链为主链,从离官能团近的一端给主链上碳原子编号;
B、烷烃命名时,要选择最长的碳链为主链,从离支链近的一端给主链上碳原子进行编号;
C、烷烃命名时,要选择最长的碳链为主链,从离支链近的一端给主链上碳原子进行编号;
D、苯的衍生物命名时,根据两个侧链的位置来分析.
解答 解:A、烯烃命名时,选含官能团的最长的碳链为主链,故主链上有4个碳原子,从离官能团近的一端给主链上碳原子编号,故在2号碳原子上有一个甲基,在1号和2号碳原子间、3号和4号碳原子间各有一条碳碳双键,故名称为:2-甲基-1,3-丁二烯,故A错误;
B、烷烃命名时,要选择最长的碳链为主链,故主链上有4个碳原子,为正丁烷,故B错误;
C、烷烃命名时,要选择最长的碳链为主链,故主链上有5个碳原子,故为戊烷,从离支链近的一端给主链上碳原子进行编号,故在3号碳原子上有一个甲基,故3-甲基戊烷,故C错误;
D、此有机物为苯的衍生物,相当于用-OH取代了苯甲酸中羧基的邻位碳上的一个H原子,故为邻羟基苯甲酸,故D正确.
故选D.
点评 本题考查了有机物的命名方法,较难的是苯的衍生物的命名,注意基础的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的量为1mol | B. | 质量大于64g | ||
| C. | 含S原子数目大于NA | D. | 含O原子的物质的量小于2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
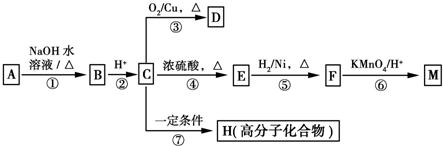
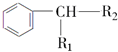 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$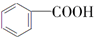 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)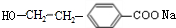 .
.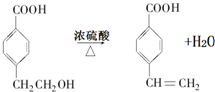 .
.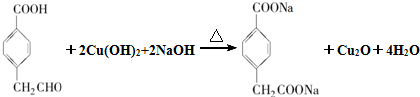 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
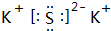 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同,组成元素也相同的化合物一定是同分异构体 | |
| B. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定是同分异构体 | |
| D. | 分子式相同的不同有机物一定互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | NH4HCO3溶液与少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 碳酸氢钠溶液水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
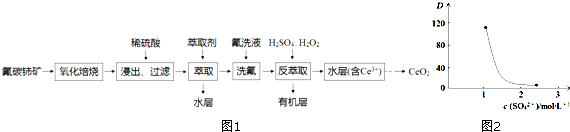
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com