
【题目】某固体混合物中可能含有K+、Na+、Cl﹣、CO32﹣、SO42﹣等离子,将该固体溶解于蒸馏水,对所得溶液进行如下实验:下列推断正确的是( )
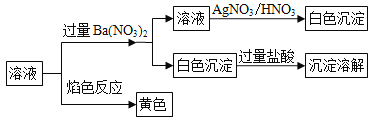
A. 该混合物一定是K2CO3和NaCl
B. 该混合物可能是Na2CO3和KCl
C. 该混合物可能是Na2SO4和Na2CO3
D. 该混合物一定是K2SO4和NaCl
【答案】B
【解析】
溶液中加入过量Ba(NO3)2,出现白色沉淀,该白色沉淀可能是BaSO4,也可能是BaCO3,也可能是它们的混合物,但白色沉淀加入过量盐酸,沉淀溶液,因此该白色沉淀为BaCO3,说明原溶液中一定含有CO32-,一定不含有SO42-,滤液中加入硝酸酸化的AgNO3溶液,出现白色沉淀,该沉淀为AgCl,说明原溶液中一定含有Cl-,焰色反应为黄色,溶液中含有Na元素,则原溶液中一定含有Na+,原溶液中可能含有K+;
溶液中加入过量Ba(NO3)2,出现白色沉淀,该白色沉淀可能是BaSO4,也可能是BaCO3,也可能是它们的混合物,但白色沉淀加入过量盐酸,沉淀溶液,因此该白色沉淀为BaCO3,说明原溶液中一定含有CO32-,一定不含有SO42-,滤液中加入硝酸酸化的AgNO3溶液,出现白色沉淀,该沉淀为AgCl,说明原溶液中一定含有Cl-,焰色反应为黄色,溶液中含有Na元素,则原溶液中一定含有Na+,原溶液中可能含有K+;
由上述分析可知,一定含Na+、Cl﹣、CO32﹣,不含SO42﹣,则一定不含Na2SO4,不能确定是否含K+,则该混合物可能是K2CO3和NaCl,可能为Na2CO3和NaCl,故选项B正确。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】(1)如下图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是_____

A.第一次平衡时,SO2的物质的量右室更多
B.通入气体未反应前,左室压强和右室一样大
C.第一次平衡时,左室内压强一定小于右室
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
(2)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g)![]() NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
(3)①室温下,在0.5mol/L纯碱溶液中加入少量水,由水电离出的c(H+)×c(OH-)_________。(填“变大”、“变小”、“不变”)
②已知Ksp(Ag2CrO4)=1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.00008mol/LK2CrO4溶液,则溶液中的c(CrO42-)=___________。
③室温下,0.1mol/LNaHCO3溶液的pH值______0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e—=Na2S+Fe,则该电池在充电时,阳极发生反应的物质是____________,放电时负极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配离子的稳定性可用K不稳衡量,例如[Ag(NH3)2]+的K不稳=![]() 。在一定温度下,向0.1mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3
。在一定温度下,向0.1mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3![]() [Ag(NH3)2]+。溶液中pNH3与δ(X)的关系如图其中pNH3=-1g[c(NH3)]、δ(X)=
[Ag(NH3)2]+。溶液中pNH3与δ(X)的关系如图其中pNH3=-1g[c(NH3)]、δ(X)= ![]() (X代表Ag+或[Ag(NH3)2]+)。下列说法正确的是
(X代表Ag+或[Ag(NH3)2]+)。下列说法正确的是

A. 图中δ1代表的是δ([Ag(NH3)2]+) B. 向溶液中滴入稀硝酸,δ(Ag+)减小
C. 该溶液中c(NH4+)+c(H+)=c(OH-) D. 该温度时,K不稳([Ag(NH3)2]+)=107.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO、H2)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列问题:
I.合成气的制取
(1)煤的气化制取合成气。
已知:①H2O(g)=H2O(l) △H=-44kJ/mol;
②部分物质的燃烧热:

则反应C(s)+H2O(g)=CO(g)+H2(g)的△H=___________kJ/mol。
(2)天然气部分氧化制取合成气。
如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中CO和H2的物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为___________。
Ⅱ.利用合成气合成乙醇
在一定条件下,向容积为2L的恒容密闭容器中投入2 mol CO和4molH2,发生反应:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)。
CH3CH2OH(g)+H2O(g)。
(1)写出该反应的平衡常数表达式___________。
(2)下列情况能作为判断反应体系达到平衡的标志是___________(填序号)。
a.压强不再变化 b.平均摩尔质量不再变化 c.密度不再变化
(3)反应起始压强记为p1、平衡后记为p2,平衡时H2的转化率为___________。(用含p1、p2的代数式表示)
Ⅲ.合成乙醇的条件选择
为探究合成气制取乙醇的适宜条件,某科研团队对不同温度、不同Rh质量分数的催化剂对CO的吸附强度进行了研究,实验数据如图。CO的非离解吸附是指CO尚未乙醇化,离解吸附是指CO已经乙醇化。
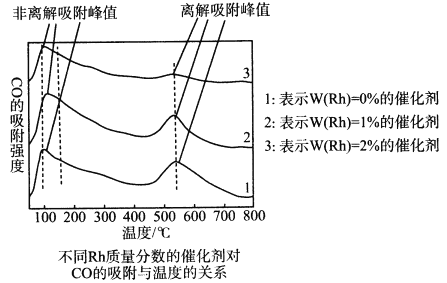
由此可见催化剂温度对CO吸附强度的影响是___________;用Rh作催化剂,合成气制取乙醇的适宜温度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是
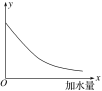
A. 溶液中H+的物质的量
B. 溶液的导电能力
C. 溶液中的c(CH3COO-)/c(CH3COOH)
D. CH3COOH的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种盐的溶解度曲线,下列说法正确的是( )
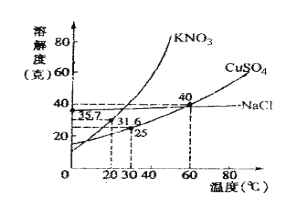
A. 40℃时,将35g食盐溶于100g水中,降温至0℃时,可析出氯化钠晶体
B. 20℃时,硝酸钾饱和溶液的质量分数是31.6%
C. 60℃时,200g水中溶解80g硫酸铜达饱和。当降温至30℃时,可析出30g硫酸铜晶体
D. 30℃时,将35g硝酸钾和35g 食盐同时溶于100g水中,溶液蒸发时,先析出的是氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法错误的是
A.分子中一定含有共价键
B.两种非金属元素形成的化合物中可能含有离子键
C.需要加热的反应不一定是吸热反应
D.化学键的断裂和形成是化学反应中能量变化的本质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证某混合气体由H2、CO和HCl组成,请从图中选择适当的实验装置设计实验,并回答下列问题。(假设每步反应均完全)
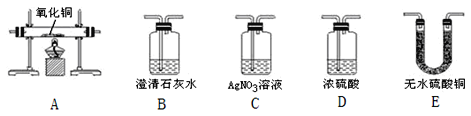
(1)装置连接的顺序是___(用字母表示)。
(2)你所选择的第一个装置的作用是_____。
(3)写出你所选最后一个装置中发生反应的化学方程式_____。
(4)A装置在实验过程中玻璃管内的现象是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com