
| A. | 78gNa2O2固体与62gNa2O固体中阴、阳离子总数均为3NA | |
| B. | 在2H2O+2Na2O2=4NaOH+O2↑的反应中,当产生标况下5.6LO2时,转移的电子数为NA | |
| C. | 1mol SiO2分子中含NA个Si原子和2NA个氧原子 | |
| D. | 54g铝与足量的稀硝酸反应产生的氢气分子数为3NA |
分析 A.过氧化钠中阴离子为过氧根离子;
B.气体状况未知;
C.二氧化硅为原子晶体;
D.硝酸与任何金属反应都不产生氢气.
解答 解:A.78gNa2O2固体物质的量为$\frac{78g}{78g/mol}$=1mol,含有2mol钠离子、1mol过氧根离子,阴、阳离子总数为3NA;62gNa2O固体物质的量$\frac{62g}{62g/mol}$=1mol,含有2mol钠离子,1mol氧离子,阴、阳离子总数为3NA,故A正确;
B.气体状况未知,无法计算氧气的物质的量和转移电子数目,故B错误;
C.二氧化硅为原子晶体,不含分子,故C错误;
D.硝酸与任何金属反应都不产生氢气,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用,掌握阿伏伽德罗常数与物质的量、摩尔质量等之间的转化关系,明确气体摩尔体积使用条件和对象是解题关键,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
 2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 标准状况下,22.4 L己烷中含氢原子数目为14NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单位时间内生成nmol A2,同时生成2n mol AB | |
| B. | 反应混合气体总压强不随时间而变化 | |
| C. | 反应混合气体密度不随时间而变化 | |
| D. | 容器中各组分的质量分数不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  闻气体的气味 | B. | 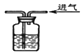 用浓硫酸干燥CO2 | ||
| C. | 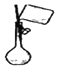 向容量瓶中转移液体 | D. | 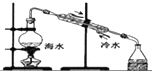 用海水提取淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 要求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| C | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| D | Fe3+ Na+、NO3-、ClO- | 溶液pH=l |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)=c(HS-)=c(K+)>c(OH-)=c(H+) | |
| B. | c(Na+)>c(K+)>c(S2-)>c(H+)>c(OH-) | |
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S)+c(SO42-) | |
| D. | c(K+)+c(Na+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com