
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
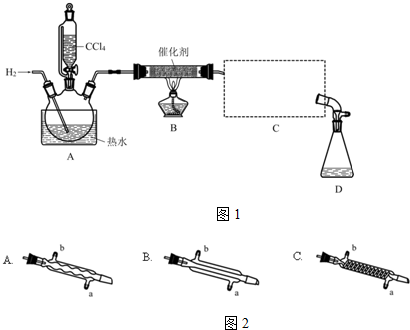
分析 (1)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿;
(2)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢;
(3)蒸馏装置中通常选用直形冷凝管,便于液体流下;冷却水采用逆流的方式冷却效果较好;
(4)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤;
(5)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可书写化学方程式.
解答 解:(1)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿,
故答案为:加热时氢气遇氧气发生爆炸;生成的氯仿被氧气氧化;
(2)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢,反应方程式为:CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl,
故答案为:CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl;
(3)蒸馏装置中通常选用直形冷凝管,便于液体流下,故选B,冷却水采用逆流的方式冷却效果较好,所以冷水应从该冷凝管的a口接入,
故答案为:B;a;
(4)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤,用以洗掉NaHCO3和NaCl,
故答案为:洗掉NaHCO3和NaCl;
(5)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{15g}{24.6g}$×100%≈61%,
故答案为:61%;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可知化学方程式为2CHCl3+O2=2COCl2+2HCl,
故答案为:2CHCl3+O2=2COCl2+2HCl.
点评 本题考查了物质制备方案的设计,题目难度中等,涉及仪器的使用、化学实验基本操作方法、化学计算等知识,试题知识点较多、综合性较强,充分考查了学生的化学实验、化学计算能力.


科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
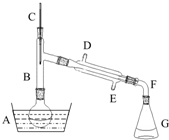 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBr
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBr| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Si | SiCl4 |
| 沸点/℃ | 2355 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
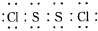 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
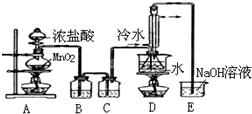
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
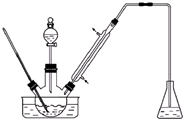 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).| 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | |
| 溴 | 160 | 3.119 | 58.8 |
| 苯甲醛 | 106 | 1.04 | 179 |
| 1,2-二氯乙烷 | 99 | 1.2351 | 83.5 |
| 间溴苯甲醛 | 185 | 1.587 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率增大,逆反应速率减小,平衡向正向移动 | |
| B. | 逆反应速率增大,正反应速率减小,平衡逆向移动 | |
| C. | 正、逆反应速率都增大,平衡不移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com