
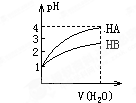
 常温时,pH=1的两种一元酸溶液HA和HB,分别加水稀释1000倍,两溶液的pH值与所加水的体积变化如图所示,下列结论中正确的是( )
常温时,pH=1的两种一元酸溶液HA和HB,分别加水稀释1000倍,两溶液的pH值与所加水的体积变化如图所示,下列结论中正确的是( )| A、在稀释过程中HA与HB溶液中c(OH-)均增大 |
| B、当稀释100倍时,HB的pH为3 |
| C、在稀释过程中当两者pH分别都是2时,c(HA)>c(HB) |
| D、等物质的量浓度的HA和HB,其酸性HA<HB |


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜锌原电池中,锌作负极,电子从锌极流向铜极 |
| B、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
| C、电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液 |
| D、电解饱和食盐水时,用铁做阳极,Cl-发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气所含有的原子数目为NA |
| B、2.4g金属镁变成镁离子时失去的电子数目为0.1NA |
| C、22.4L甲烷的质量与NA个甲烷分子的质量之和相等 |
| D、标准状况下,22.4LN2和O2混合物所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量是一种基本物理量,符号为n,单位为摩尔 |
| B、摩尔是一种基本物理量 |
| C、摩尔质量等于该物质的相对分子质量 |
| D、每摩尔物质只能含有阿伏伽德罗常数个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO2-+6H2O=4Al(OH)3↓ |
| B、碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| C、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D、小苏打溶液跟烧碱溶液反应:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol CO2的质量为44g/mol |
| B、CO2的摩尔质量为44g |
| C、CO2的摩尔质量等于CO2的相对分子质量 |
| D、当摩尔质量的单位是g/mol时,CO2的摩尔质量与其相对分子质量数值相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com