
����Ŀ����ͬԪ�ص�ԭ���ڷ������������ӵ�������С����һ��ֵX����ʾ����XԽ����ԭ���������ӵ�����Խǿ�������γɵķ����г�Ϊ�����һ����������ijЩ������Ԫ�ص�Xֵ��
Ԫ�� | Li | Be | B | C | O | F |
Xֵ | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
Ԫ�� | Na | Al | Si | P | S | Cl |
Xֵ | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
��1��ͨ������Xֵ�ı仯���ɣ�ȷ��N��Mg��Xֵ��Χ����X��Mg������ ��X��N���� ��
��2���Ʋ�Xֵ��ԭ�Ӱ뾶�Ĺ�ϵ�� ��
��3��ij�л���ṹ��ʽΪ ![]() ����S��N�У�����Ϊ���õ��Ӷ�ƫ��˭����дԭ�����ƣ���
����S��N�У�����Ϊ���õ��Ӷ�ƫ��˭����дԭ�����ƣ���
��4��������ɸ������ǵ��ɼ�����ԭ����ӦԪ�ص縺�ԵIJ�ֵ��X��1.7ʱ��һ��Ϊ���Ӽ�������X��1.7ʱ��һ��Ϊ���ۼ������ƶ�AlBr3�л�ѧ����������
��5��Ԥ��Ԫ�����ڱ��У�Xֵ��С��Ԫ��λ����������Ԫ�س��⣩��
���𰸡�
��1��0.93��1.57��2.55��3.44
��2��ͬ���ڣ���ͬ���壩Ԫ�أ�xֵԽ��ԭ�Ӱ뾶ԽС
��3����
��4�����ۼ�
��5���������ڵڢ�A��
���������⣺��1���ɱ�����ֵ�ɿ�����ͬ������Ԫ�ص�xֵ��ԭ�Ӱ뾶�ļ�С������ͬ�������϶���xֵ��С��xֵ�ı仯���������Եı仯���ʣ�0.93��x��Mg����1.57��2.55��x��N����3.44�� ���Դ��ǣ�0.93��1.57��2.55��3.44����2���ɱ�����ֵ�ɿ�����ͬ������Ԫ�ص�xֵ��ԭ�Ӱ뾶�ļ�С������ͬ�������϶���ԭ�Ӱ뾶����xֵ��С�����Դ��ǣ�ͬ���ڣ���ͬ���壩Ԫ�أ�xֵԽ��ԭ�Ӱ뾶ԽС����3���Ա����ڱ��жԽ���λ�õ�Xֵ��֪��X��B����X��Si����X��C����X��P����X��O����X��Cl���������֪��X��N����X��S��������S��N�У����õ��Ӷ�Ӧƫ��ԭ�ӣ����Դ��ǣ�������4�����֪��AlCl3�ġ�X=1.55��1.7����X��Br����X��Cl��������AlBr3�ġ�XӦС��AlCl3�ģ�Ϊ���ۼ������Դ��ǣ����ۼ�����5�����ݵݱ���ɣ�Xֵ��С��ӦΪCs��FrΪ������Ԫ�أ�λ�ڵ������ڡ��ڢ�A�壬���Դ��ǣ��������ڵڢ�A�壮


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A. ����Ͷ�뵽NaOH��Һ�У�2Al+2OH���T2AlO2��+H2��
B. �������Ȼ�����Һ��Ӧ��![]()
C. ������ˮ�ķ�Ӧ��Cl2+ H2O �T 2H+ + Cl- + ClO-
D. Ư����Һ��ͨ�������CO2��ClO- + CO2 + H2O �T HClO + HCO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ���Al2O3,����Fe2O3��SiO2����֪SiO2������ˮ��Ҳ����ǿ���ǿ�Ӧ��������,�����в���������������ȡAl2O3���ش���������:

(1)д��������Ļ�ѧʽ:a______; f______��
(2)д���������NaOH��Һʱ��������Ҫ��Ӧ�����ӷ���ʽ:________________��______________��
(3)д��ͨ������B(����)ʱ��ҺC�з�����Ӧ�����ӷ���ʽ:___________________��_______________��
(4)����������Ҫ�Ļ�����,��ѧ��ѧ�������������������������������,�� Fe(OH)2 ת����Fe(OH)3������Ϊ___________________________��ͬʱ��Ԫ�ػ�����������FeSO4��7H2O��һ��dz��ɫ����,�׳��̷�,�����ڴ����������������ӵķ�ˮ�������̷���ij������ˮ(����ǿ����������Cr2![]() O72-)���д�����������������Cr2
O72-)���д�����������������Cr2![]() O72-����ԭΪCr3+��д��������������FeSO4��7H2O��Cr2
O72-����ԭΪCr3+��д��������������FeSO4��7H2O��Cr2![]() O72-��Ӧ�����ӷ���ʽ��_______________________________________________________________________________
O72-��Ӧ�����ӷ���ʽ��_______________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��5��18�գ��й���Ϊȫ����ʵ�ֺ���ɹ����ɿ�ȼ���Ĺ��ң���ȼ����һ�ּ����ˮ��������йؼ����˵����ȷ����
A. ����ʽΪCH4 B. ��������ˮ C. �����²��ȶ� D. �ǿ�������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������I1��ָ��̬ԭ��X��g��ʧȥһ�����ӳ�Ϊ��̬������X+��g�������������ͼ�Dz���Ԫ��ԭ�ӵĵ�һ������I1��ԭ�������仯������ͼ�� ��ش��������⣺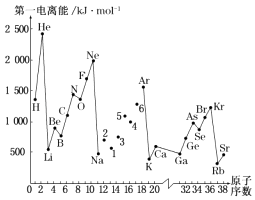
��1����ͼ������֪��ͬһ����Ԫ��ԭ�ӵĵ�һ������I1�ı仯������ ��
��2��ͼ��5��Ԫ�������ڱ��е�λ������ ��
��3��ͼ��4��5��6����Ԫ�ص���̬�⻯��ķе����ͬ������һ���ڵ�Ԫ����̬�⻯��ͺܶ࣬ԭ���ǣ� ��
��4����̬�ԭ��ʧȥ���ⲻͬ��������������ֱ�Ϊ��ʧȥ��һ����Ϊ519kJmol��1 �� ʧȥ�ڶ�������Ϊ7296kJmol��1 �� ʧȥ����������Ϊ11 799kJmol��1 �� �ɴ����ݷ���Ϊ���ԭ��ʧȥ����ڶ�������ʱ���������ҪԶԶ����ʧȥ��һ��������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֶ�����Ԫ�أ����ǵĽṹ�����ʵ���Ϣ���±�������
Ԫ�� | �ṹ�����ʵ���Ϣ |
A | �Ƕ������У���ϡ�������⣩ԭ�Ӱ뾶����Ԫ�أ���Ԫ�ص�ij�ֺϽ���ԭ�ӷ�Ӧ�ѵĵ��ȼ� |
B | B��Aͬ���ڣ�������������ˮ��������� |
C | Ԫ�ص���̬�⻯�K������ˮ������������� |
D | �Ǻ�ˮ�г��⡢��Ԫ���⺬������Ԫ�أ��䵥�ʻ���Ҳ������ˮ���������г��õ�����ɱ���� |
����ݱ�����Ϣ��д��
��1��Aԭ�ӵĺ�������Ų�ʽ ��
��2��BԪ�������ڱ��е�λ�������Ӱ뾶��BA������ڡ���С�ڡ�����
��3��Cԭ�ӵĵ����Ų�ͼ�� �� ��ԭ�Ӻ�������δ�ɶԵ��ӣ�������ߵĵ���Ϊ����ϵĵ��ӣ��������Σ�
��4��Dԭ�ӵĵ����Ų�ʽΪ �� D���Ľṹʾ��ͼ�� ��
��5��B������������Ӧ��ˮ������A������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽΪ��D���⻯���ˮ���ﷴӦ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ�����ϡ���ɫ��ѧ����һ������ǣ�������
A. �ƹ������ʹ�ù�����ͨ���߳���
B. �ոѾ͵ط��գ���������ɱ�
C. ������չ̫���ܺͷ�������
D. ��ȼú����������SO2�Կ�������Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�����������Ӧ�������¿��ܴ���������ǣ� ��
A.��ʹpH��ֽ������Һ�У�CO32����K+��Cl����Na+
B.![]() �T10��10mol/L����Һ�У�Na+��HCO3����Cl����K+
�T10��10mol/L����Һ�У�Na+��HCO3����Cl����K+
C.��c��OH����/c��H+��=1��1012����Һ�У�NH4+��Fe2+��Cl����NO3��
D.��ˮ���������c��OH����=1��10��12mol/L����Һ�У�NO3����Mg2+��Na+��SO42
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�ѧ�仯��ʵ���ǾɵĻ�ѧ�����ѡ��µĻ�ѧ���γ���һ���ۣ��ж����б仯�ǻ�ѧ�仯����
A.�����Ȼ�������ˮB.������������ˮ
C.�������ȱ��ˮ����D.�Ȼ�������ˮ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com